От чего зависит судьба гена
Из результатов исследований, проведенных в последние годы, стало ясно, что все эти свойства гистоновых “хвостов” чрезвычайно важны для расшифровки механизмов функционирования хроматина - его поведения при активации генов, их репрессии и регуляции многих других процессов, связанных с доступом к ДНК. К настоящему времени создана не одна модель, объясняющая роль хроматина, самая разработанная и интригующая из них - модель “гистонового кода”.
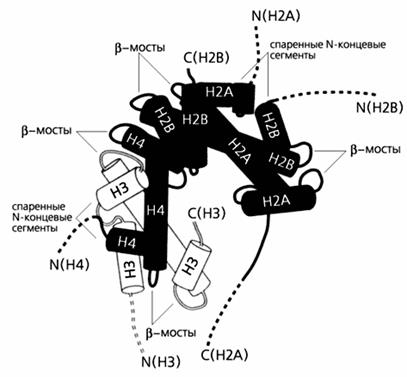
Схематическое изображение фрагмента нуклеосомы.
На схеме видны: мотив гистоновой укладки в виде цилиндров, соединенных петлями и взаимодействующих между собой, и шесть регулярно расположенных -мостов, связывающих спираль ДНК. Приблизительное положение гибких гистоновых “хвостов” изображено пунктирными линиями.
Под этим подразумевается разнообразный набор модификаций гистоновых “хвостов”, определяющий функциональное состояние гена. Спектр модификаций можно целенаправленно менять, передавать по наследству, иными словами, управлять считыванием генетической информации. Именно “гистоновый код” являет собой тот второй и, видимо, основной эпигенетический механизм, который управляет включением-выключением генов и передачей контролирующей программы по наследству от клетки к клетке.
Язык, на котором ДНК разговаривает с клеткой
Довольно долго существовало мнение, что структура хроматина статична, что он отнюдь не главный игрок на поле генной регуляции. Гистонам же отводилась лишь пассивная роль в сворачивании чрезмерно длинной для ядра молекулы ДНК. Считали (так было проще думать), что контроль транскрипции в клетках эукариот независим от хроматина. Однако после того как была расшифрована структура нуклеосомы, в корне изменились представления о хроматине и о значимости гистонов, в частности. Они оказались непосредственно вовлеченными в процессы, происходящие на ДНК-матрице, такие как репликация (удвоение ДНК), транскрипция, репарация (исправление повреждений ДНК) и расхождение хромосом [6]. Стало ясно, что существует тщательная инструкция для факторов транскрипции, использующих различные ферменты, которые напрямую или опосредованно способствуют перестройке хроматина.
Участие хроматина в судьбе генов стало еще очевиднее, когда в составе активирующих и репрессорных белковых комплексов, управляющих работой гена, были обнаружены ферменты, вносящие или снимающие некоторые модификации в гистоновых “хвостах”. От количества модификаций, их качественного состава и специфического набора зависело, быть гену активным или молчать. Выяснилось также, что мутации генов, кодирующих ферменты-модификаторы, приводят к полной потере клеткой способности развиваться и в конечном счете к гибели. “Гистоновый код” оказался идеальным эпигенетическим механизмом, с помощью которого пишется программа каскадного включения-выключения генов, а информация о белках, записанная в самой ДНК, остается в сохранности.
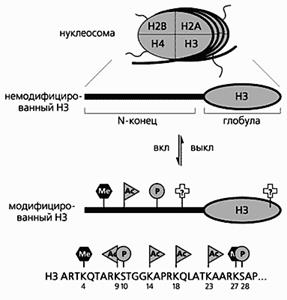
Схема расположения модифицирующих групп в N-концевой части гистона-3.
Этот консервативный домен выходит на поверхность фибриллы и подвергается, как и “хвосты” других гистонов, разным модификациям: ацетилированию (Ас), фосфорилированию (Р) и метилированию (Ме). Вполне возможны и некоторые модификации в глобулярном домене. Внизу показаны точные места модификаций N-концевого фрагмента Н3 человека
(здесь приведены однобуквенные обозначения аминокислот). Остаток лизина (К-9) может быть как ацетилирован, так и метилирован.
Места модификации гистонов весьма консервативны, специфичны и специализированы так, чтобы в клетке протекали необходимые для ее жизни процессы. В Н3 и Н4 модификациям подвергаются в основном аминокислоты с реакционноспособными боковыми группами, как правило, положительно заряженными. Чаще всего это лизины. Если в опытах все лизиновые остатки, находящиеся в “хвосте” Н4, заменяли на другие аминокислоты, терялась возможность модификации, и клетка погибала. Когда в этом гистоне место лизинов в “хвостовом” домене занимали глутамины (аминокислоты с другим суммарным зарядом), нарушалось распределение зарядов на поверхности нуклеосомы, необходимое для нормального деления клетки, и оно останавливалось. Однако если возвращали всего один остаток лизина на N-конец гистона, клетка продолжала делиться.
Поддержание генов в активном или неактивном состоянии обеспечивается комбинациями разных модификаций, причем по определенным аминокислотам и в определенном положении. Любой модифицированный остаток может способствовать или препятствовать “пришиванию” следующей химической метки.
Модификацией гистоновых “хвостов”, естественно, занимаются ферменты. Каждый из них присоединяет только определенную модифицирующую группу. Например, гистоновая ацетилтрансфераза переносит ацетильную группу на конкретные лизины в аминном конце, метилтрансфераза - метильную группу (на лизиновые и/или аргининовые остатки), а гистоновые киназы - фосфатные радикалы на серины и гистидины. Существуют также и многочисленные ферменты, которые снимают модифицирующие группы с гистоновых “хвостов”. Такие ферменты входят в состав сложных белковых комплексов, участвующих в регуляции генной активности. Из сказанного следует, что в клетке достигается определенный баланс между различными ферментами, которые считывают “гистоновый код” и переключают его, меняя степень конденсированности хроматина и, соответственно, активности гена.
По гипотезе “гистонового кода”, маркировки на модифицированных концевых доменах гистонов должны узнаваться регуляторными белками. И это уже подтверждено в экспериментах. Выяснилось, что белковые регуляторы содержат так называемый бромодомен (обнаруженный, кстати, первым), распознающий ацетилированные лизины. Присутствует он во многих регуляторах транскрипции генов. В одном из них - белке TAFII250 (субъединице базального транскрипционного фактора TFIID) - имеются две последовательно расположенные копии бромодомена, и каждая узнает свою ацетильную группу. В этом тоже проявляется комбинаторный характер “гистонового кода”. Бромодомен обнаружен более чем в 75 белках человека. В некоторых из них бывает по нескольку - до шести - копий, и тогда они способны узнавать уникальную комбинацию ацетильных групп, сформировавшуюся на “хвостах” разных гистонов.
Следующим был обнаружен хромодомен; он реагирует на метильные метки в гистоновых “хвостах”. Среди белков с хромодоменом лучше всего изучен гетерохроматиновый белок - НР1 (англ. Нeterochromatin Рrotein), участвующий в структурной организации гетерохроматина (так называют области хроматина, находящиеся в высококонденсированном состоянии), где ни один ген не работает. Следовательно, НР1 - это маркер неактивного состояния хроматина. Связываясь с метилированным по девятому лизину “хвостом” гистона-3 в одной нуклеосоме, гетерохроматиновый белок способствует метилированию Н3 в соседней частице, и CН3-метка “расползается” по хроматину [6]. В результате его протяженные участки переходят в высококонденсированное состояние. Гены, попавшие в эту область, перестают работать (генетики это часто называют эффектом положения).
