Простейшие бифункциональные природные соединения - мостик к массиву природных соединений
Введение
Изучение полифункциональных природных соединений целесообразно начать с классов оксикислот, оксокислот и аминоспиртов, поскольку, во-первых, эти соединения достаточно широко представлены в живом мире на различных этапах его проявления — они встречаются в свободном виде и как фрагменты достаточно сложных молекул, некоторые из них образуются в процессе метаболизма веществ первичного биосинтеза или являются ключевыми соединениями главных путей биосинтеза. Второй аргумент в пользу выделения такой группы природных соединений в начало нашего курса — это наглядность проявления внутримолекулярного взаимного влияния функциональных групп, ведущего к появлению новых физических и химических свойств относительно исходных простых функций как важного фактора формирования молекул жизни.
1. Гидроксикислоты
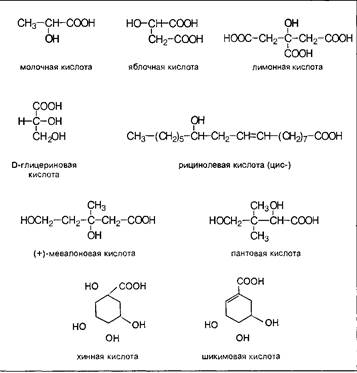
Соединения этого класса являются достаточно простыми представителями природных соединений, они весьма часто встречаются в самых различных природных источниках. Гидроксиалкановые кислоты были выделены из ланолина, пчелиного воска, коры, корней, воскообразного слоя листьев, семян, бактерий и грибов. Наиболее часто встречаются б-гидроксикислоты, a в комбинации со сфингозинами животных и фитосфингозинами растений и Микроорганизмов они, очевидно, входят в состав всего живого.
В-гидроксикислоты играют важную роль в биосинтезе и катаболизме жирных кислот. Жирные кислоты с длинной цепью с одной и более гидроксильными группами обнаружены в жирах растительного и животного происхождения. В таких молекулах гидроксильные функции находятся, главным образом, на некотором расстоянии от карбоксильной группы.
Некоторые оксикислоты являются ключевыми соединениями на главных путях биосинтеза, пантовая кислота входит в состав кофермента А. Простейшая оксикислота гликолевая, НО-СН2-СООН, содержится в незрелом винограде, свекле, сахарном тростнике. Природная яблочная кислота, имеющая конфигурацию, содержится в кислых плодах, таких как незрелые яблоки, крыжовник, рябина, ревень. Лимонная кислота — важный продукт обмена веществ в живых организмах, некоторыми растениями накапливается в значительных количествах — в плодах цитрусовых — 6-8%, в листьях махорки — 8-14%, культуральными жидкостями некоторых бактерий — до 10%.
Следует отметить доступность многих гидроксикислот в лабораторных синтезах, а некоторых и в более крупных масштабах, что позволяет в ряде случаев использовать в практических целях синтетические вещества этого класса вместо труднодоступных соединений, полученных из природных источников.
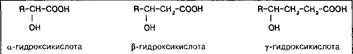
Классификация гидроксикислот построена по общему принципу классификации бифункциональных соединений — согласно взаимному расположению функциональных групп при углеродной цепи и количеству этих функциональных групп. Очень многие природные гидроксикислоты имеют тривиальные названия, которые прочно укоренились в химической и биохимической практике.
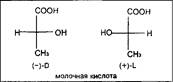
В структурном плане для этих соединений характерно появление молекулярного асимметрического центра, что позволяет присутствовать им в природных источниках в трех формах- -изомера, -изомера и -изомера. К примеру, молочная кислота образуется при молочнокислом брожении лактозы в виде рацемической смеси, тогда как в животном организме в результате гликолиза образуется -О-молочная кислота, которая накапливается в мышцах при интенсивной работе, вызывая характерную мышечную боль.
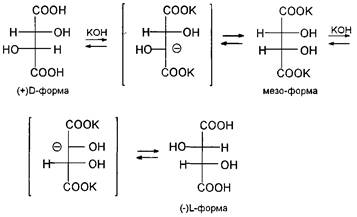
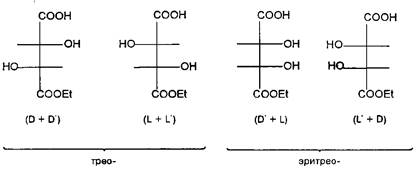
Молекула винной кислоты, образующаяся в процессе брожения виноградного сока, имеет два асимметрических центра, а так как каждый из них может иметь D- и L-конфигурации, то это соединение принципиально может образовать уже четыре конфигурационных изомера:,, и. Так как в молекуле винной кислоты оба асимметрических центра имеют одинаковое окружение и собственно одинаковое вращение, т.е. D=D' и L=L\ то изомеры и идентичны между собой и оптически неактивны. Фактически молекула этой конфигурации имеет плоскость симметрии и молекулярная асимметрия в ней исчезает. Такой изомер, представляющий собой как бы внутримолекулярный рацемат, называют мезоформой. Этерификация одной карбоксильной группы мезоформы винной кислоты приводит к нарушению симметрии молекулы и, соответственно, к возникновению оптической активности у изомеров и.
Та винная кислота, которая образуется при брожении виноградной кислоты, имеет -0-конфигурацию, еще ее называют виннокаменной кислотой. Остальные изомеры получают рацемизацией природной -0-винной кислоты, которая при кипячении со щелочью образует смесь D, L-рацемата и мезоформы Процесс рацемизации винной кислоты обусловлен ее С-Н-кислыми свойствами — в щелочной среде она образует карбанион, который легко инвертирует.
Таким образом, мы получаем общую картину конфигурационной изомерии молекул с двумя асимметрическими центрами, согласно которой такие соединения могут существовать в четырех стереоизомерных формах — паратреоизомеров и пара-эритро-изомеров. Мезоформа, являющаяся результатом идентичности двух асимметрических центров, представляет собой частный случай эритроформы.
Треоизомеры являют собой пару энантиомеров, также как и эритро-изомеры. Относительно друг друга трео-и эритроизомеры определяются как диастереомеры. Если известно, что энантиомеры являются друг относительно друга оптическими антиподами, т.е. различаются только по своему отношению к плоскополяризованному свету, то диастереомеры различаются между собой целым рядом физических и химических свойств, так как они имеют различное взаимное расположение функциональных групп внутри молекул, а следовательно отличаются молекулярной формой, геометрическими параметрами, взаимным влиянием несвязанных атомов.
По химическим свойствам оксикислоты являют сумму свойств спиртов и карбоновых кислот, сочетая эти свойства в одной молекуле, и в то же время они проявляют ряд новых свойств, обязанных взаимному влиянию функциональных групп друг на друга или взаимодействию этих групп между собой. К таким появляющимся новым свойствам можно отнести: образование циклических диэфиров, лактидов из боксикислот и легкость их окисления до кетокислот; легкость реакций в-элиминирования в случае в-оксикислот; образование внутримолекулярных сложных эфиров из г-оксикислот. б-Оксикислоты образуют комплексные соединения хелатного типа.
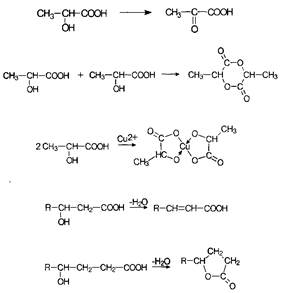
Часто лактонная форма для г-окси-кислот является даже более выгодной, чем оксикислотная, и г-оксикислоты самопроизвольно переходят в циклическую форму. Это характерно для таких известных соединений этого класса как пантовая кислота, многие сескви-терпены. Стабильными макроцикличес-кими лактонами представлены некоторые антибиотики и длинноцепочечные оксикислоты из группы мускусов; легко образует лактон и мевалоновая кислота.
