Регулирование белкового синтеза
Термин «трансляция» обозначает передачу наследственной информации от иРНК к белку. Проще говоря, «перевод» последовательности трехчленных кодонов иРНК в последовательность аминокислот синтезируемого белка.
В учебнике Беркинблит, Глаголева и Фуралева этот процесс описан достаточно подробно. Напомню главные его черты. Во всех относительно малых (около 80 нуклеотидов) транспортных РНК (тРНК) имеется однонитевой участок («петля»), где располагается «антикодон» — тройка нуклеотидов, комплементарных кодону. Антикодон водородными связями соединяется с кодоном, и в этом состоит «узнавание» кодона, определяющее аминокислоту, которая должна быть присоединена к растущей цепи белка. Различных тРНК в клетке имеется, как минимум, 20 — по числу аминокислот.
На 3'-конце всех тРНК стоит тройка нуклеотидов ЦЦА. К ней специальный фермент, «аминоацил-тРНК-синтетаза», ковале-нтной связью присоединяет аминокислоту, соответствующую антикодону этой тРНК. Образуется молекула «аминоа-цил-тРНК». Условимся для краткости обозначать ее аа-тРНК. Процессы «узнавания» кодона и синтеза белка происходят в рибосоме. Ее образуют две субъединицы — малая и большая. Суммарный их диаметр порядка 25 миллимикрон. В каждой из субъединиц имеется набор специфических белков и молекулы крупных рибосомальных РНК: одна — в малой субъединице и две (а у эукариотов три) — в большой. Молекулярные веса этих pPHK лежат в диапазоне 0,5-1,5 миллиона дальтон (от 1541 до 4718 нуклеотидов). Малые pPHK рибосом (есть и такие) имеют длину всего 120-160 нуклеотидов.
Белки рибосом, общим числом около 55-ти (в среднем) у прокариотов и 83-х у эукариотов обеспечивают последовательность этапов биосинтеза конечного белка: посадку рибосомы на иРНК, ее продвижение вдоль матрицы, переброску растущей цепи белка с одной молекулы тРНК на другую, окончание трансляции и снятие рибосомы с матрицы иРНК. В этих процессах участвуют и некоторые белки цитоплазмы, временно связывающиеся с рибосомой — так называемые «факторы» инициации, элонгации и терминации белкового синтеза.
Рибосомы эукариотов значительно крупнее, чем у бактерий. Возможна посадка на иРНК и нескольких рибосом, следующих друг за другом. Такая комбинация именуется «полисомой».
В клетке E.coli насчитывается около 20 тысяч рибосом. Место присоединения рибосом к иРНК для E.coli известно. Это — последовательность АГГАГГУ-З, расположенная на 10 нуклеотидов ранее АУГ — начального кодона для синтеза белка. Считают, что 3'-конец рРНК малой субъединицы рибосомы E.coli комплементарен к этой последовательности.
Относительно рибосом высших организмов полагают, что они садятся произвольно со стороны 5'-конца иРНК, а затем «скользят» по ней до тех пор, пока не встретят инициаторный кодонАУГ в специальном окружении: АЦЦАУГГ.
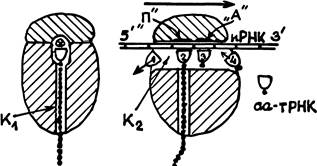
Нам известно, что субъединицы рибосом (малая и большая) синтезируются порознь. Посадку рибосомы на определенное для нее место на иРНК осуществляет малая субъединица. Большая субъединица к ней затем присоединяется. Снятие рибосомы с матрицы иРНК, очевидно, осуществляется путем разъединения субъединиц. Перед этим в рибосому вместо очередной аа-тРНК входит некий специальный белок (RF-release factor). Он вытесняет из рибосомы остающуюся в ней часть полипептидной цепочки белка. У эукариотов часть рибосом по своей большой субъединице связывается с внутриклеточными мембранами. Синтезируемые ими белки попадают в аппарат Гольджи и секретируются клеткой наружу. Рибосомы в цитоплазме обеспечивают собственные потребности клетки. После завершения синтеза полипептидной цепи белка начинается посттрансляционная трансформация белка, в частности, его сворачивание в глобулу. (Впрочем, не исключено, что для крупных белков это сворачивание начинается еще в процессе трансляции.) Сворачиванию белков в клетке способствуют еще и специальные белки — «помощники». В английской терминологии они именуются «molecular chaperones» (компаньоны). Короткие белки (меньше 300 аминокислот) легко сворачиваются в одну компактную структуру — «домен». Крупные белки эукариотов иногда сворачиваются в два или три домена, связанных короткими отрезками полипептидной цепочки. Трансформация белка перед его сворачиванием может включать в себя и химическую модификацию некоторых аминокислот: присоединение Сахаров или липидов — особенно для белков мембран. Возможны и некоторые укорачивания полипептидной цепи экзопептидазами (в интересах лучшего сворачивания) и т. д. Вернемся теперь к более подробному анализу центрального процесса — синтеза полипетидной цепи белка в рибосоме по матрице иРНК. Основные представления об этом процессе были изложены выше. Но в этих представлениях есть немало скрытых «темных мест». Я предупреждаю: все последующее является гипотезой автора, которую я предлагаю для критического рассмотрения своим ученикам. На рис. изображена рибосома в двух разрезах. Я предполагаю, что в большой субъединице есть два канала К1 и К2.
MET
Рис.
Левая схема — разрез рибосомы плоскостью, перпендикулярной к иРНК, проходящей через вертикальный канал Кр иРНК здесь изображена маленьким кружком с перекрестием. На правом разрезе она видна, как узкая полоска, где кодоны отмечены черточками. Это — разрез плоскостью, проходящей через иРНК и оба канала. Из сопоставления разрезов видно, что горизонтальный канал имеет вытянутое вниз сечение. Вертикальный канал — круглый. Пронумерованные половинки эллипсов изображают молекулы тРНК. Их прямолинейные участки — антикодоны. Черная точка у вершины полуэллипса — аминокислота. Цепочка черных точек, выходящая из Ki — новосинтезированный фрагмент белка. Нижняя точка на этой цепочке — метионин, с которого начинался синтез белка.
Рибосома продвигается вдоль иРНК слева направо скачками — сразу на целый кодон. (Направление движения 5'-3'). Изображен момент, когда такой скачок только что закончился. Освободившаяся тРНК № 1 покидает рибосому. На тРНК № 2, находящейся в «сайте» П, сидит уже синтезированный фрагмент белка. На тРНК № 3 (в сайте А) — следующая аминоацил-тРНК. аа-тРНК № 4 только входит в канал Kg, она еще не сблизилась со «своим» кодоном.
Во время следующего скачка рибосомы вправо последняя аа-тРНК подойдет к этому кодону, «узнает» его и окажется в сайте А, в том положении, которое на рисунке занимает аа-тРНК № 3. В это же время весь фрагмент белка оторвется от тРНК № 2 и присоединится пептидной связью к аминокислоте, принесенной тРНК № 3, а сама эта тРНК уже окажется в сайте П — над вертикальным каналом К1 — в положении, которое на рисунке занимает тРНК № 2. Цепь белка удлинится тем самым на одно звено. «Отработавшая» тРНК № 2 оторвется от своего кодона и начнет выходить из рибосомы.
Теперь обратимся к проблеме генетического кода.
Напомню, что из 64-х триплетных кодонов в иРНК три кодона (УАА, УАГ и УГА) диктуют окончание синтеза белка и снятие рибосомы с иРНК. Остальные кодоны «значащие», то есть диктующие присоединение к синтезируемой цепи белка определенных аминокислот. Надо разобраться в этой «определенности». Мы знаем, что генетический код — вырожденный. 61 кодон иРНК распоряжается включением в белок всего 20-ти аминокислот. Было даже замечено, что на каждую аминокислоту приходится по 3 кодона. На самом деле распределение отнюдь не такое равномерное.
