Рост аксона
Кончик растущего аксона удлиняется, образуя конус роста. Рамон-и-Кахаль первым обнаружил, что конус роста является частью аксона, ответственной за навигацию и удлинение его в направлении конечной цели . Конус роста удлиняется и сокращается за счет широких пластинок, называемых ламмелиподиями, и тонких, остроконечных выпячиваний, называемых филоподиями Филоподий достигают размеров в несколько десятков микрометров и могут удлиняться и сокращаться, как бы ощупывая субстрат во всех направлениях. Филоподий адгезируют к определенному субстрату и тянут конус роста в этом направлении.
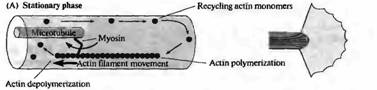
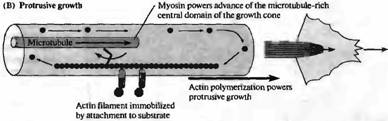
Актин играет ключевую роль в подвижности конуса роста (рис. 1) . Как ламеллиподии, так и филоподий богаты филаментным актином и веществами, ингибирующими полимеризацию актина, такими как грибной токсин цитохалазин В, обездвиживающий конусы роста. Выпячивание и ретракция ламеллиподий и филоподий, а также движение вперед самого конуса роста, скорее всего, управляется двумя процессами: (1) полимеризацией и разборкой актиновых филаментов и (2) зависимой от миозина транслокацией актиновых филаментов прочь от ведущего края конуса роста. Оба процесса используют энергию гидролиза АТФ и могут управляться белками, связывающими актин. Кальций, протеинкиназы и другие внутриклеточные вторичные посредники управляют активностью актин-связывающих белков. Например, остановка роста и ретракция конуса роста, два частых события в процессе роста аксонов, связаны с входящим током кальция и увеличением частоты кратковременных повышений концентрации кальция в цитоплазме клетки.
|
|
|
Рис. 1. Модель подвижности конусов роста на основе актина. (А) Поперечный срез (слева) и вид сверху (справа) на конус роста в стационарной фазе. Миозин, связанный с микротрубочками, обеспечивает движение актиновых филаментов в направлении назад, в то время как в филаментах постоянно происходит процесс полимеризации со стороны ведущего края конуса роста и деполимеризация в центре. (В) Аналогичные изображения конуса роста во время роста. Актиновые филаменты иммобилизировались присоединением к субстрату. Полимеризация актина в этом случае приводит к продвижению конуса роста, в то время как миозин обеспечивает движение микротрубочек вперед, продвигая центральный домен конуса роста. |
Молекулы адгезии клетки и внеклеточного матрикса и рост аксона
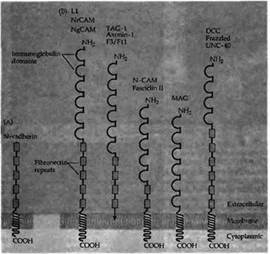
Молекулы клеточной адгезии управляют ростом аксона, обеспечивая наиболее благоприятное окружение для вытягивания конуса роста. Клеточные молекулы адгезии представляют собой трансмембранные или связанные с мембраной гликопротеины, характеризующиеся структурными мотивами своих внеклеточных частей, которые во многом гомологичны постоянным доменам иммуноглобулинов и фибронектина 3 типа (рис.2). Представителями надсемейства этих иммуноглобулинов (Ig) являются клеточные молекулы адгезии (N-CAM), молекулы адгезии нейроглии САМ (NgCAM), TAG-1, MAG, и DCC83). Эти молекулы обеспечивают адгезию клеток друг к другу посредством гетерофильных связей между различными надсемействами иммуноглобулинов (например, связь между NrCAM и TAG-1). Дополнительно присутствующей везде молекулой клеточной адгезии является молекула N-кадгерина (N-cadherin, рис. 2), которая обеспечивает кальций-зависимую адгезию между клетками.
В культуре клеток экспрессия N-CAM и N-кадгерина в клетках приводит к их агрегации, вытягиванию аксонов в сторону клеточных субстратов, но не субстратов внеклеточного матрикса, а также соединению отдельных растущих аксонов в пучки (фасцикулы, fascicles). Стимуляция роста аксонов молекулами клеточной адгезии не обеспечивается просто «липкостью» субстрата; она управляется активацией рецепторов, связанных с тиро1инкиназой, например рецептора к фактору роста фибробластов (fibroblast growth factor, FGF).
|
Рис. 2. Два класса молекул адгезии нервных клеток. (А) N-кадгерин способствует гомофильной кальций-зависимой адгезии. (В) Члены надсемейства иммуноглобулинов характеризуются многочисленными повторами связанных друг с другом дисульфидными мостиками циклов, которые гомологичны доменам, впервые описанным в постоянной части молекул иммуноглобулина. Многие из этих молекул клеточной адгезии также содержат несколько доменов, сходных с повторами в фибронектине III типа (показано в виде прямоугольников). У различных видов животных имеется большое количество гомологичных белков со сходными именами. |
|
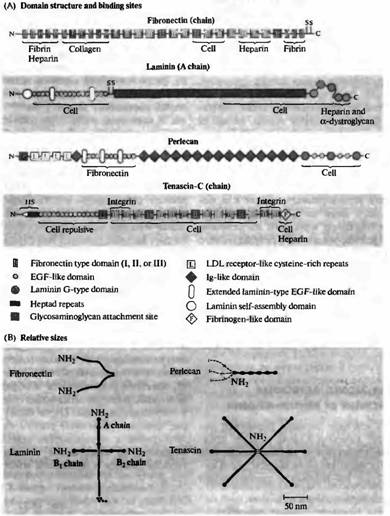
Рецептор FGF включает внутриклеточный каскад, связанный с фосфорилированием тирозина, что приводит к удлинению аксона. Белковая тирозинфосфатаза, фермент, удаляющий остатки фосфата с тирозина, также участвует в регулировании этих сигналов. Молекулы адгезии внеклеточного матрикса, включая ламинин, фибронектин, тенасцин (Л, цитотактин), а также перлецан, тоже являются благоприятным субстратом для роста нервных отростков85· 86). Эти гликопротеины с большой массой имеют две или более сходные субъединицы, удерживаемые вместе благодаря дисульфидным мостикам (рис. 2). Каждая субъединица характеризуется повторяющимися структурными мотивами. Белки внеклеточного матрикса взаимодействуют с клетками через семейство рецепторов, называемых интегринами. Было идентифицировано большое количество изоформ субъединиц интегрина. Каждая комбинация приводит к формированию рецепторов с различными свойствами. Интегрины обеспечивают структурные связи между белками внеклеточного матрикса и внутриклеточным актиновым цитоскелетом, регулируя форму клетки и ее миграцию. Кроме того, они активируют внутриклеточные сигнальные пути, которые управляют ростом клетки, пролиферацией и дифференцировкой.
Исследования при помощи специальных блокирующих антител показывают, что конусы роста редко используют только один субстрат для своего движения; несколько типов молекул адгезии клетки и внеклеточного матрикса могут обеспечивать рост нервных отростков у определенных типов нейронов. Например, для полного ингибирования роста аксонов в сторону шванновской клетки необходимо применять одновременно антитела к Ll/NgCAM, N-кадгерину и интегринам. Один тип антител сам по себе не может помешать росту аксона.
|
|
|
Рис. 3. Белки внеклеточного матрикса, опосредующие адгезию клеток к субстрату и отталкивание. (А) Схематическое представление доменной структуры цепей, состоящей из фибронектина, ламинина (А цепь), перцелана и тенасцина-С, а также участков, к которым присоединяются клетки, коллаген, гепарин, фибронектин, интегрин, фибрин и альфа-дистрогликан. S указывает на расположения остатков цистеина, которые образуют дисульфидные мостики между цепочками. Тенасцин-С содержит как связывающие, так и отталкивающие домены; основной его эффект, однако, отталкивание клеток и конусов роста. (В) Молекулы, изображенные в определенном масштабе. Все, кроме перцелана, являются олигопротеинами, цепи связаны друг с другом дисульфидными мостиками. Пунктирной линией показан гепарансульфат 90 и 170 нм длиной, связанный с N терминальным доменом перцелана. (Из Engel Л., 1992.) |