Сахарная свекла
Основными энергоносителями являются глюкоза и жирные кислоты. На рис. 2 представлены пути превращений глюкозы и жиров, а также белков и аминокислот.
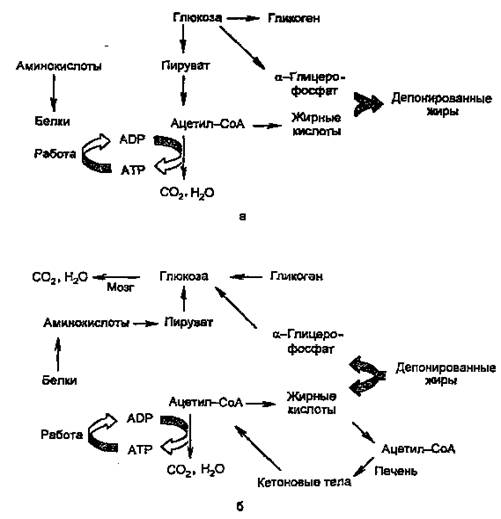
Рисунок 2. Изменение метаболизма основных энергоносителей при смене абсорбтивного (а) и постабсорбтивного (б) состояний.
Как видно из рисунка, при смене режимов многие процессы меняют направление на противоположное. За каждой из стрелок — серия реакций; ферменты, катализирующие ключевые реакции (лимитирующие скорость данной метаболической цепи), находятся под контролем многих регулирующих механизмов, включающих в качестве первого (внеклеточного) вестника сигнала главным образом инсулин и глюкагон, а также адреналин и кортизол.
Первичными сигналами для смены состояний являются изменение концентрации глюкозы в крови и вызванные этим реципрокные изменения концентраций инсулина и глюкагона. Регуляцию метаболизма инсулином и глюкагоном невозможно рассматривать по отдельности. В крови постоянно присутствуют оба гормона, однако изменяются их относительные концентрации. Действие каждого из них часто направлено на одни и те же конкретные мишени. Например, инсулин через путь Ras одновременно активирует гликогенсинтазу и ингибирует гликогенфосфорилазу, а глюкагон через сАМР-зависимые протеинкиназы одновременно ингибирует гликогенсинтазу и активирует гликогенфосфорилазу. Другой пример: инсулин сокращает не базальную скорость глюконеогенеза, а только скорость, стимулированную глюкагоном. На рис. 3 показаны некоторые другие мишени метаболических путей глюкозы в печени, общие для инсулина и глюкагона. Кроме того, инсулин снижает секрецию и самого глюкагона.
Глюкоза проникает в гепатоциты путем облегченной диффузии при участии ГЛЮТ-2, не зависимого от инсулина и имеющего высокую Км. В гепатоцитах глюкоза быстро превращается в глюкозо-6-фосфат глюкокиназой (гексокиназой IV), которая тоже имеет высокую Км (12 мМ) и не ингибируется продуктом реакции (в отличие от гексокиназ I, II и III). Далее глюкозо-6-фосфат может использоваться по трем направлениям: синтез гликогена, гликолиз, пентозофосфатный путь. Следует отметить, что ацетил-СоА, образующийся из глюкозы, используется для синтеза жирных кислот и жиров. Все эти пути стимулируются инсулином на пре- или посттрансляционном уровне.
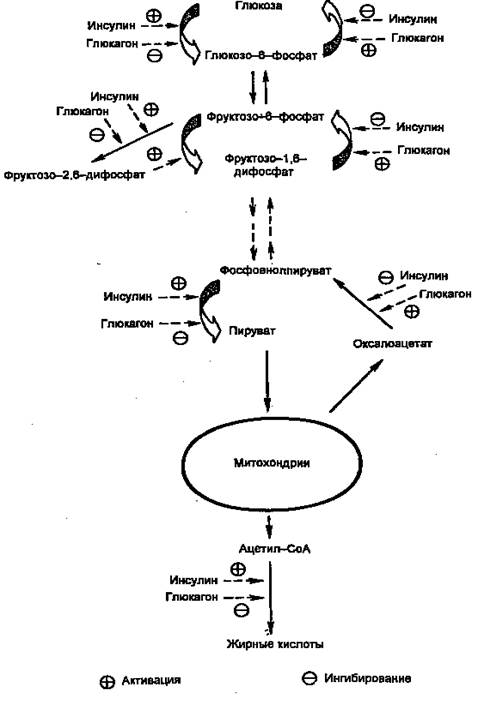
Рисунок 3. Действие инсулина и глюкагона на метаболизм глюкозы в печени.
Регуляция на претрансляционном уровне в свою очередь может быть двух типов: стимуляция транскрипции и повышение стабильности мРНК. В печени необратимые реакции гликолиза, а также синтез гликогена и синтез жиров стимулируются инсулином и подавляются глюкагоном. Наоборот, необратимые стадии глюконеогенеза подавляются инсулином и стимулируются глюкагоном. Подобная ситуация имеет место и в метаболизме жиров и аминокислот (белков): инсулин стимулирует их синтез, а глюкагон — мобилизацию. Поэтому направление метаболических процессов в сторону запасания или мобилизации зависит не столько от абсолютной концентрации гормона, сколько от отношения их концентраций ([инсулин]/[глюкагон], инсулин/глюкагоновый индекс). Для того, чтобы понять механизмы метаболических нарушений при инсулин-зависимом диабете, необходимо рассмотреть механизмы синтеза и секреции инсулина, так как нарушение этих процессов — одна из причин развития заболевания.
СИНТЕЗ И СЕКРЕЦИЯ ИНСУЛИНА
Молекула инсулина построена из двух пептидных цепей: цепь А содержит 21 аминокислотный остаток, цепь Б — 30 остатков. Цепи соединены между собой двумя дисульфидными мостиками (рис. 7.6). Инсулины многих животных очень сходны по первичной структуре. С инсулином человека наиболее сходен инсулин свиньи, различие в одной позиции: в цепи Б в 30-й позиции (С-концевой остаток), у человека Тре, у свиньи — Ала.
Инсулин образуется из препроинсулина в результате посттрансляционной модификации. Ген препроинсулина в геноме человека представлен единственной копией. В настоящее время интенсивно изучаются строение промоторной области и механизмы регуляции гена инсулина.
Синтез препроинсулина происходит на полирибосомах, связанных с эндоплазматическим ретикулумом. Препроинсулин проникает в люмен ретикулума, где от него отщепляется лидирующая последовательность — N-концевой фрагмент, содержащий 24 аминокислотных остатка. Образовавшийся проинсулин (86 аминокислотных остатков) перемещается затем в аппарат Гольджи, где упаковывается в секреторные гранулы. В аппарате Гольджи и секреторных гранулах происходит превращение проинсулина в инсулин. В этом превращении участвуют две эндопептидазы: прогормонконвертазы 2 и 3 (ПГ2 и ПГЗ; последнюю называют также ПГ1). Эти ферменты расщепляют связи Арг32—Глу33 и Арг65—Гли66. Затем С-концевые остатки Apr и Лиз отщепляются карбоксипептидазой Е (КП-Е; известна также как КП-Н). Этот фермент есть во многих других органах, участвует в процессинге ряда гормонов и нейромедиаторов.
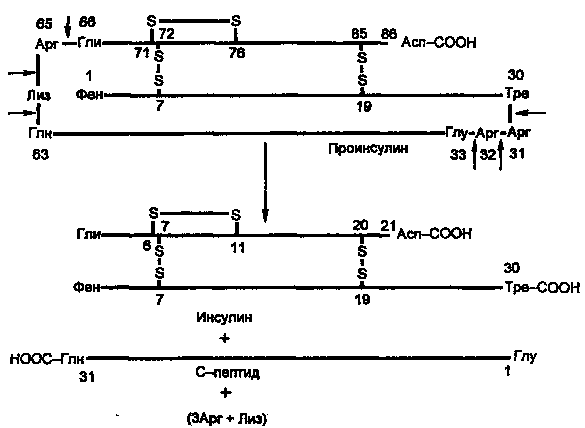 Рисунок 4. Процессинг проинсулина.
Рисунок 4. Процессинг проинсулина.
Таким образом, в секреторных гранулах содержатся (и секретируются из них) инсулин и С-пептид в эквимолярных количествах. Долгое время С-пептид рассматривали как физиологически неактивное вещество. Недавно было обнаружено, что в физиологических концентрациях он стимулирует потребление глюкозы клетками мышц здорового человека и больных ИЗСД примерно в такой же мере, как инсулин.
Глюкоза регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. Транскрипция ряда генов, связанных с метаболизмом, активируется в поджелудочной железе, печени и жировых клетках при потреблении пищи, содержащей углеводы.
Действие глюкозы может быть прямым, когда сама глюкоза или ее метаболиты непосредственно взаимодействуют с аппаратом регуляции гена, или вторичным, обусловленным влиянием глюкозы на секрецию гормонов, главным образом инсулина и глюкагона. Однако выяснить, что является регулятором — инсулин или глюкоза, можно только при использовании клеточных культур, позволяющих строго контролировать содержание этих веществ в среде (см. табл.).
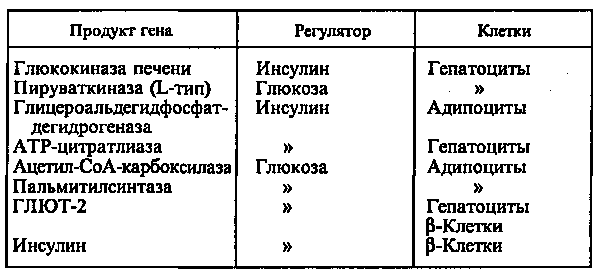
При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, а количество инсулиновой мРНК в клетке возрастает в результате активации транскрипции и стабилизации мРНК. Активация транскрипции требует образования метаболитов глюкозы на стадиях гликолиза. Синтез и секреция инсулина не являются прочно сопряженными процессами. Например, при отсутствии ионов Са2+ в среде глюкоза не стимулирует секрецию инсулина, в то время как синтез активируется. Глюкоза стимулирует синтез инсулиновой мРНК при продолжительной инкубации (2—72 ч). При инкубации в течение 1 ч сколько-нибудь существенного увеличения мРНК не происходит, в то же время включение меченых аминокислот в проинсулин возрастает в 10—20 раз. Актиномицин D (ингибитор транскрипции) при этом не подавляет синтез проинсулина. Из этого следует, что первоначальная стимуляция синтеза (в течение примерно 20 мин после добавления глюкозы) происходит с использованием предсуществующей мРНК и регулируется на уровне трансляции.
