Энергетика химических процессов
При высоких температурах самопроизвольно можут протекать реакции, сопровождающиеся увеличением энтропии, при низких температурах – только экзотермические реакции.
Процессы, протекающие с уменьшением энтальпии (![]() ) и увеличением энтропии (
) и увеличением энтропии (![]() ), практически необратимы. В этом случае
), практически необратимы. В этом случае ![]() всегда будет иметь отрицательное значение, какую бы температуру не применяли. Так, для реакции
всегда будет иметь отрицательное значение, какую бы температуру не применяли. Так, для реакции
2КClO3 = 2KCl+3O2
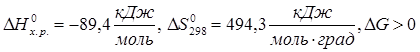 при любой температуре.
при любой температуре.
Под стандартной энергией Гиббса образования ![]() понимают изменение энергии Гиббса при реакции образования 1 моля вещества в стандартных условиях из простых веществ, находящихся в стандартном состоянии.
понимают изменение энергии Гиббса при реакции образования 1 моля вещества в стандартных условиях из простых веществ, находящихся в стандартном состоянии.
Стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса, как и изменение энтальпии системы, не зависит от пути процесса. Поэтому для реакции вида
![]()
изменение стандартной энергии Гиббса ![]() равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
![]() .
.
Для реакции NO + 1/2О2 = NO2
![]() 86,58 0 51,5
86,58 0 51,5 ![]() кДж/моль.
кДж/моль.
При пользовании значениями ![]() критерием принципиальной возможности процесса в нестандартных условиях следует принять условие
критерием принципиальной возможности процесса в нестандартных условиях следует принять условие ![]() , а критерием принципиальной невозможности осуществления процесса - неравенство
, а критерием принципиальной невозможности осуществления процесса - неравенство ![]() . Равенство
. Равенство ![]() означает, что система находится в равновесии.
означает, что система находится в равновесии.
Во многих случаях значениями ![]() можно пользоваться лишь для приближенной оценки направления протекания реакций.
можно пользоваться лишь для приближенной оценки направления протекания реакций.
|
Состояние |
| |
|
CF4 |
-375,8 (вещество инертное, стабильное) | |
|
NCl3(ж) |
70 (вещество взрывоопасное) | |
|
|
-5,61 |
Реакционная способность возрастает |
|
C3H6 |
14,99 | |
|
C3H4 |
46,47 | |
Чем отрицательнее значение ![]() вещества, тем данное химическое соединение устойчивее. И наоборот, чем положительней
вещества, тем данное химическое соединение устойчивее. И наоборот, чем положительней ![]() , тем менее устойчиво данное вещество.
, тем менее устойчиво данное вещество.
![]() известны для немногих соединений, но вместе с тем с помощью
известны для немногих соединений, но вместе с тем с помощью ![]()
![]() и
и ![]() можно вычислить
можно вычислить ![]() для десятков тысяч реакций, в том числе предполагаемых и не изученных экспериментально.
для десятков тысяч реакций, в том числе предполагаемых и не изученных экспериментально.
В складских помещениях сосредоточены большие количества разнообразных по ассортименту и физико–химическим (в том числе и пожароопасным) свойствам веществ. При нарушении правил хранения возможно образование смесей, способных к экзотермическим реакциям. Такие смеси представляют значительную пожарную опасность. Одни смеси, образованные при контакте негорючего окислителя с горючим, самовозгораются (KMnO4+глицерин; CrO3+ацетон). Другие смеси воспламеняются или взрываются от удара, трения или нагревания (KClO3+сера). Третьи смеси, образованные из негорючих компонентов, при взаимодействии нагревается от теплоты реакции (CaO+вода) или взрываются (KClO3+H2SO4).
Пожарную опасность веществ и их смесей можно определить по энергии Гиббса ![]() , которая является мерой реакционной способности веществ. Как было показано ранее, реакции между веществами, сопровождающиеся большой потерей энергии Гиббса, протекают самопроизвольно и до конца, иногда приобретают взрывной характер. В этих реакциях энергия Гиббса отрицательна, то есть в исходном состоянии системы (реагирующих веществ) она больше, чем в конечном (продуктов реакции).
, которая является мерой реакционной способности веществ. Как было показано ранее, реакции между веществами, сопровождающиеся большой потерей энергии Гиббса, протекают самопроизвольно и до конца, иногда приобретают взрывной характер. В этих реакциях энергия Гиббса отрицательна, то есть в исходном состоянии системы (реагирующих веществ) она больше, чем в конечном (продуктов реакции).
Ориентировочно за величину, определяющую направленность процесса, принимают значение 41,8 кДж/моль. Если для реакции расчетом получено ![]() , то реакция возможна не только в стандартных, но и в нестандартных условиях.
, то реакция возможна не только в стандартных, но и в нестандартных условиях.
Если ![]() , то процесс невозможен как в стандартных, так и в иных условиях. По изменению энергии Гиббса от -41,8 до 41,8 кДж/моль нельзя сделать заключения о возможности протекания процесса в стандартных условиях, но вещества относятся к пожароопасным, хотя эти свойства у них появляются в условиях, отличных от стандартных (например, во время пожара).
, то процесс невозможен как в стандартных, так и в иных условиях. По изменению энергии Гиббса от -41,8 до 41,8 кДж/моль нельзя сделать заключения о возможности протекания процесса в стандартных условиях, но вещества относятся к пожароопасным, хотя эти свойства у них появляются в условиях, отличных от стандартных (например, во время пожара).
Если для веществ по расчету получено ![]() , то вещества, участвующие в реакции, пожароопасны и несовместимы. К совместному хранению такие вещества не допускаются. При
, то вещества, участвующие в реакции, пожароопасны и несовместимы. К совместному хранению такие вещества не допускаются. При ![]() вещества совместимые и допускаются к совместному хранению.
вещества совместимые и допускаются к совместному хранению.
Возможность использования энергии Гиббса для оценки пожарной опасности вещества подтверждается следующими примерами.
Пример 1. Определить пожарную опасность разложения твердого окислителя KMnO4 при нагревании. Разложение вещества идет по схеме:
2KMnO4 Þ K2MnO4 + MnO2 + O2.
Решение. Из справочника термодинамических величин находим ![]() веществ, кДж/моль:
веществ, кДж/моль:
![]() KMnO4 – 729,6
KMnO4 – 729,6
