Батареи и элементы питания (Аккумуляторы)Рефераты >> Технология >> Батареи и элементы питания (Аккумуляторы)
|
|
Содержание
|
|
|
1. |
Введение | |
|
2. |
Марганцово – цинковые и оксидно – ртутные элементы | |
|
3. |
Соединение элементов в батареи | |
|
4. |
Кислотные аккумуляторы | |
|
5. |
Щелочные аккумуляторы | |
|
Список литературы |
1. ВВЕДЕНИЕ
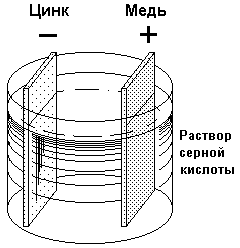
Если отсутствует электрическая сеть, то для питания электроприборов применяют гальванические элементы и аккумуляторы, называемые иначе химическими источниками тока. Рассмотрим принцип их работы на примере первого простейшего элемента – элемента Вольта (рис. 1). Он состоит из медной (Сu) и цинковой (Zn) пластинок, опущенных в раствор серной кислоты (H2SO4). Вследствие химической реакции, происходящей между цинком и серной кислотой, на цинке образуется излишек электронов. Цинк заряжается отрицательно и является отрицательным полюсом. Раствор и медная пластинка, в него погруженная, заряжаются положительно. В результате возбуждается ЭДС, равная примерно одному вольту, которая сохраняется все время, пока цепь не замкнута.
Если замкнуть цепь, пойдет ток и внутри элемента усиленно начнет выделяться водород, покрывающий поверхность пластинок слоем пузырьков. Этот слой уменьшает напряжение на полюсах элемента. Такое явление носит название поляризации. Чем больше ток, тем сильнее поляризация и тем быстрее уменьшается напряжение элемента.
|
Рис.1. Простейший гальванический элемент Вольта. |
Для устранения поляризации в элемент вводят вещества, способные поглощать водород и называемые деполяризаторами. Чтобы напряжение на полюсах оставалось постоянным, деполяризатор должен быстро поглощать водород, образующийся при работе элемента. Поглощая водород, деполяризатор постепенно приходит в негодность. Но обычно раньше этого портится электролит и под действием электролита разъедается цинк. Вообще электрическая энергия получается в элементе за счёт расхода цинка, электролита и деполяризатора; поэтому каждый элемент обладает определенным запасом энергии и может работать лишь ограниченное время.
Работа гальванических элементов объясняется с помощью теории электролитической диссоциации, согласно которой молекулы вещества, растворенного в воде распадаются (диссоциируют) на, ионы. Такое явление характерно для всех электролитов, представляющих собой растворы кислот, щелочей и солей. В элементе Вольта молекула серной кислоты (H2SO4) в водном растворе распадаются на отрицательный ион кислотного остатка (SO4) и положительный ион водорода (H2), что показано на рис. 2.
Химическая реакция между цинком и серной кислотой состоит в том, что положительные ионы цинка переходят в раствор, притягиваясь к отрицательным ионам электролита. При этом цинковый электрод сам заряжается отрицательно. Между ним и электролитом возникает разность потенциалов, а следовательно, и электрическое поле, которое препятствует дальнейшему переходу положительных ионов цинка в раствор. Поэтому создается некоторое равновесие с определенной разностью потенциалов между цинком и раствором. Для других металлов и растворов значение разности потенциалов будет иное.
Чтобы использовать возникшую разность потенциалов, в электролит помещают второй электрод, выполненный из другого металла. Если второй электрод – цинковый, то между ним и растворов получится такая же разность потенциалов, как у первого электрода но она будет действовать навстречу, и результирующая разность потенциалов между электродами будет равна нулю. У элементов отрицательный электрод, как правило, цинковый, а положительный электрод обычно медный или угольный.
Если соединить электроды элемента проводником, т. е. создать замкнутую цепь, то под действием разности потенциалов по внешней цепи от цинка будут двигаться электроны. Так как они уходят с цинкового электрода, то его отрицательный потенциал начинает уменьшаться и электрическое поле между ним и раствором ослабевает. Но тогда новые положительные ионы цинка переходят в раствор. Тем самым поддерживается определенный отрицательный потенциал цинкового электрода.
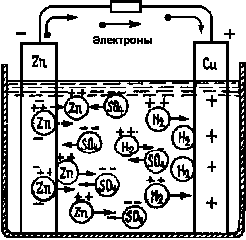
Рис.2. Ионы в электролите элемента Вольта.
При работе элемента непрерывно происходит растворение цинка в электролите, который постепенно превращается в раствор сернокислого цинка (ZnSO4). Положительные ионы цинка, переходящие все время в электролит, притягивают к себе отрицательные ионы кислотного остатка. Эти ионы в электролите данжутся в направлении от медной пластинки к цинковой. Зато положительные ионы водорода отталкиваются положительными ионами цинка и движутся в обратном направлении, то есть от цинка к меди. Таким об разом, если во внешней цепи ток представляет собой движение электронов (как и всегда в металлических проводниках), то в электролите ток является перемещением положительных и отрицательных ионов в противоположных направлениях. Ионы водорода подходят к медной пластинке и отнимают от нее электроны, превращаясь в нейтральные атомы. Вследствие этого на медной пластинке поддерживается определенный положительный потенциал, несмотря на то, что к ней из внешней цепи прибывают электроны. Однако медная пластинка постепенно покрывается слоем водорода. Между этим слоем и электролитом возникает разность потенциалов, действующая навстречу основной разности потенциалов, имеющейся между электродами. Возникновение такой противоэлетродвижущей силы и называется поляризацией элемента. Вследствие поляризации результирующая разность потенциалов уменьшается и действие элемента ухудшается.
Гальванические элементы характеризуются разными параметрами и прежде всего электродвижущей силой, внутренним сопротивлением, максимальным допустимым разрядным током и емкостью.
Электродвижущая сила обусловливается типом элемента, то есть материалом его электродов, веществом электролита и деполяризатора. Она совершенно не зависит от размеров элемента (размеров его электродов), количества электролита и количества деполяризатора.