Возможности экологического воспитания школьников при изучении темы Кальций и его соединенияРефераты >> Педагогика >> Возможности экологического воспитания школьников при изучении темы Кальций и его соединения
2. Какие минералы содержат кальций и как их используют?
3. Расскажите, как отличить один природный минерал от другого.
V. Домашнее задание (3 мин.)
Ответьте на вопросы и выполните упражнения 1–15, § 48,49, решите упражнения 1–4, стр. 132–133 [14].
Именно таким образом выглядит план урока в школе по теме «Кальций и его соединения».
Исходя из вышеизложенного, очевидна необходимость наполнения школьного курса химии экологическим содержанием. Результаты проделанной работы будут изложены в третьей главе.
3. Использование экологических знаний при изучении темы «Кальций и его соединения
Бесспорно, что сегодня образованному человеку не обойтись без экологических знаний. В общеобразовательных учреждениях проблема решается введением дисциплины «Экология». В случае, когда это невозможно, вопрос решается через экологизацию школьных дисциплин. На уроках химии учитель поднимает многие экологические проблемы, обсуждает вместе с учащимися возможные пути их решения.
Вашему вниманию представляется урок на тему: «Кальций и его соедирнения», наполненный экологическим содержанием, позволяющий оценить важную роль перспективы развития экологического воспитания школьников, выявить взаимосвязь между изучаемым объектом и окружающей средой, а также определить роль уроков химии при формировании экологической самосознания школьников, их способности применять знания и навыки для достижения основной цели экологии – охраны окружающей природной среды.
3.1 Урок по теме «Кальций и его соединения» в 9-ом классе с. Карасу, позволяющий развить экологическое сознание школьников
Цель урока: познакомить учащихся с основными способами получения кальция и его соединений, возможностями применения соединений кальция, показать необходимость контроля содержания ионов кальция и магния в питьевых и сточных водах и обозначить значимость кальция как биогенного элемента.
Задачи обучения: сформировать понятиекальций, соединения кальция, расширить представление о способах применения различных минералов, содержащих кальций, в промышленности. Развить экологическое сознание и воспитание школьников, дать возможность ученику понять необходимость изучения экологических проблем для дальнейшего предотвращения загрязнения окружающей природной среды.
Задачи развития: продолжить развитие у учащихся основных приемов мышления (умения анализировать, сравнивать и т.д.), совершенствовать умение учащихся самостоятельно работать с дополнительной информацией. Развить экологическое сознание школьников, заложить в основу воспитания представления о взаимосвязи состава, строения, свойств и биологической функции веществ, их двойственной роли в живой природе.
Задачи воспитания: продолжить экологическое воспитание школьников.
Ход урока
II. Организационный момент (1–2 мин.)
– посадка детей;
– проверка принадлежностей;
– отметка отсутствующих и т.д.
II. Опрос домашнего задания (10 мин.)
4. Какие щелочные металлы Вы можете назвать?
5. Какое положение они занимают в периодической системе элементов Д.И. Менделеева?
6. Как получают натрий и калий?
7. Щелочные металлы являются сильными восстановителями или окислителями?
8. Какое место занимает кальций и магний в периодической системе элементов Д.И. Менделеева?
9. Где в промышленности применяют гидроксиды натрия и калия?
10. Какую степень окисления проявляет кальций и магний в соединениях?
III. Изучение нового материала (20 мин.)
1. Характеристика магния и кальция. Соединения кальция.
Таблица 1. Схема строения атомов магния и кальция
|
Химический знак |
Размещение электронов по энергетическим уровням |
Электронная формула |
|
Mg |
+12 Mg 2e-, 8e-, 2e- |
1s2 / 2s22p6 / 3s2 |
|
Ca |
+20 Ca 2e-, 8e-, 8e-, 2e- |
…3s23p63d0 / 4s2 |
Положение магния и кальция в периодической системе и строение их атомов. Магний и кальций в периодической системе находятся в главной подгруппе группы. Схемы строения их атомов представлены в таблице. Как видно из схемы, последние два электрона у атомов магния и кальция расположены на наружном энергетическом уровне. Этим и объясняется, что магний и кальций во всех соединениях проявляют степень окисления +2.
2. Нахождение в природе.
По распространенности в земной коре кальций занимает пятое место – его содержание составляет 3,38% по массе. Кальций встречается только в виде соединений, чаще всего солей кислородсодержащих кислот. Известно около 400 минералов, содержащих данный элемент. Наиболее распространенны различные силикаты и алюмосиликаты, в частности анортит Ca3[Al2Si2O8], диопсид CaMg[SiO6], волластонид Ca[Si3O9], также промышленное значение имеют кальцит (известняк, мрамор, мел)CaCO3, доломит CaMg(CO3)2 фосфорит Ca5(PO4)3(OH, CO3), апатиты Ca5(PO4)3(F, Cl), гипс CaSO4 ∙ 2 H2O, флюорит CaF2 и др. Значительное количество кальция находится в природных водах вследствие существования глобального карбонатного равновесия между практически нерастворимым карбонатом кальция, хорошо растворимым гидрокарбонатом кальция и находящимся в воде и воздухе диоксиде углерода. Заметное количество кальция содержится в организме человека и животных, в частности, гидроксилапатит – в костной ткани позвоночных, карбонат кальция – в раковинах моллюсков, яичной скорлупе.
3. Получение. Кальций получают путем электролиза его расплавленного хлорида.
4. Физические свойства. Кальций – металл серебристо-белого цвета, очень легкий (ρ = 1,55 г./см3), как и щелочные металлы, но несравненно тверже их и имеет гораздо более высокую температуру плавления, равную 851 0С.
5. Химические свойства. Подобно щелочным металлам кальций является сильным восстановителем, что схематически можно изобразить так:
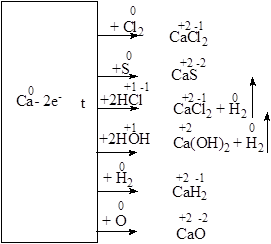
Соединения кальция окрашивают пламя в кирпично-красный цвет. Как и щелочные металлы, металлический кальций обычно хранят под слоем керосина.
6. Применение кальция основано на следующих моментах: при металлотермическом получении урана, тория, циркония, цезия, рубидия и некоторых лантаноидов из их соединений, для удаления примесей кислорода, азота, серы, фосфора из сталей, бронз и других сплавов, для обезвоживания многих органических жидкостей, очистки аргона от примесей азота, в качестве геттер в вакуумных устройствах, легирующего элемента для алюминиевых сплавов и модифицирующей добавки для магниевых сплавов. Сплавы кальция со свинцом являются антифрикционными материалами в производстве подшипников. Еще большее применение нашли соединения кальция. Например, карбонат кальция применяют в качестве антацидного средства, при повышенной кислотности желудочного сока, хлорид кальция организму необходим для осуществления передачи нервных импульсов, сокращения сердечных и скелетных мышц, для формирования костной ткани, свертывания крови и нормальной деятельности других органов и систем.
