Галогены
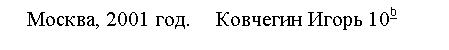 |
Галогены
Всем известно, что фтор вводят в состав зубной пасты, а хлором дезинфицируют воду в плавательных бассейнах. Бром применяют в качестве успокоительного средства, а спиртовой раствор йода как антисептическое средство. Фтор, хлор, бром и йод образуют семейство галогенов. Галогены относятся к неметаллическим элементам. Они входят в VII группу периодической системы (см. рис.).
 |
Названия всех галогенов, за исключением фтора, происходят от греческих слов:
| Название | Исходное слово | Значение |
|
Галоген |
галс (греч.) ген (греч.) |
Соль Образующий |
|
Фтор |
флуо (лат.) |
Течь, текучий (в старину минерал полевой шпат CaF, использовали в металлургии в качестве флюса для придания легкоплавкости шлакам) |
|
Хлор |
хлорос (греч.) |
Зеленовато-желтый |
|
Бром |
бромос (греч.) |
Зловонный |
|
Иод |
иодес (греч.) |
Фиолетовый |
|
Астат |
астатос (греч.) |
Неустойчивый |
Слог «ген» в качестве приставки либо суффикса входит во многие научные термины, например в слова генератор и антиген. Обычно он означает рост или образование чего-либо. Таким образом, слово галоген (гало + ген) означает «образующий соль».
ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
Атомы всех галогенов имеют во внешней оболочке семь электронов. Они легко присоединяют еще один электрон, образуя галогенидные ионы. Галогенид-ион имеет устойчивый октет электронов. Галогены характеризуются высокой электроотрицательностью и реакционной способностью и поэтому в свободном виде не встречаются в природе. Однако галогенид-ионы широко распространены в природе.
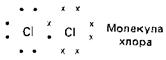
Галогены в свободном виде существуют в форме двухатомных молекул. Атомы в этих молекулах связаны между собой простой ковалентной связью. Каждая такая связь образуется в результате обобществления пары электронов - по одному от каждого атома:
В табл. 1 приведены некоторые данные о структуре атомов и молекул галогенов. Обратим внимание на то, что атомные и ионные радиусы галогенов, а также длины связи в их молекулах последовательно возрастают при перемещении к нижней части группы. Однако энергии диссоциации связи и, следовательно, прочность связи в молекулах галогенов при этом, наоборот, уменьшаются. Исключением в этом отношении является только фтор. Небольшая прочность связи фтора, по-видимому, обусловлена слишком близким расположением атомов в его молекуле. Это приводит к сильному отталкиванию между несвязывающими электронами, что вызывает ослабление связи.
Таблица 1. Электронное строение и свойства галогенов
|
Элемент |
Атомный номер |
Электронная конфигурация атомов |
Конфигурация внешней оболочки |
Атомный радиус, нм |
Ионный радиус, нм |
Длина связи, нм |
Энергия диссоциации связи, кДж/моль |
|
Фтор |
9 |
2.7 |
2s22p5 |
0,072 |
0,136 |
0,142 |
158 |
|
Хлор |
17 |
2.8.7 |
Зs23p5 |
0,099 |
0,181 |
0,200 |
242 |
|
Бром |
35 |
2.8.18.7 |
4s24р5 |
0,114 |
0,195 |
0,229 |
193 |
|
Иод |
53 |
2.8.18.18.7 |
5s25р5 |
0,133 |
0,216 |
0,266 |
151 |
ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
Хлор. Хлор можно получить в лабораторных условиях окислением концентрированной соляной кислоты манганатом(VII) калия:
![]()
Выделяющийся хлор пропускают через воду, чтобы удалить следы хлороводородов, а затем через концентрированную серную кислоту, чтобы осушить его. Полученный хлор собирают в перевернутом сосуде, из которого он вытесняет воздух.
Другой способ лабораторного получения хлора основан на реакции между отбеливающим порошком (гипохлоритом кальция) и разбавленной соляной кислотой:
![]()
Бром. Для получения брома в лабораторных условиях добавляют оксид марган-Ha(IV) к смеси концентрированной серной кислоты с бромидом калия. Бромоводород-ная кислота, обоазуюшаяся в оеакции между сеоной кислотой и бромидом калия:
![]()
окисляется оксидом марганца(IV)
![]()
Бром отделяют от реакционной смеси перегонкой.
