Глюкоза
План.
1. Общие сведения (3 страница)
а) D-глюкоза
— a-D-глюкоза
— b-D-глюкоза
б) L-глюкоза
3. Нахождение в природе (4 страница)
4. Получение (5 страница)
5. Применение (5 страница)
6. Физические свойства (6 страница)
7. Химические свойства (6 страница)
8. Рибоза и дезоксирибоза (7 страница)
9. Некоторые интересные факты (8 страница)
10. Литература (10 страница)
Формула глюкозы C6H12O6.
Глюкоза — моносахарид, одна из восьми изомерных альдогексоз. Молярная масса 180 г/моль. Глюкоза в виде D-формы (декстоза, виноградный сахар) является самым распространённым углеводом. D-глюкоза (обычно её называют просто глюкозой) встречается в свободном виде и в виде олигосахаридов (тростниковый сахар, молочный сахар), полисахаридов (крахмал, гликоген, целлюлоза, декстран), гликозидов и других производных. В свободном виде D-глюкоза содержится в плодах, цветах и других органах растений, а также в животных тканях (в крови, мозгу и др.). D-глюкоза является важнейшим источником энергии в организмах животных и микроорганизмов. Как и другие моносахариды D-глюкоза образует несколько форм. Кристаллическая D-глюкоза получена в 2-х формах: a-D-глюкоза (рисунок 1) и b-D-глюкоза (рисунок 2).
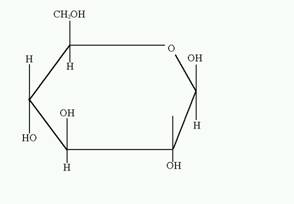
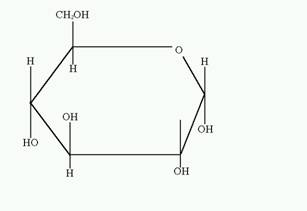
Рисунок 1 (a-D-глюкопираноза) Рисунок 2 (b-D-глюкопираноза)
a-D-глюкоза
tпл 146°С [a]D= + 112,2° (в воде), кристаллизируется из воды в виде моногидрата с tпл 83°С.
b-D-глюкоза
Получают кристаллизацией D-глюкозы из пиридина и некоторых других растворов. tпл 148-150°С, [a]D= + 18,9° (в воде).
В водном растворе устанавливается равновесие между несколькими взаимопревращающимися формами D-глюкозы: a- и b-пиранозными , a- и b-фуранозными, открытой альдегидной
(рисунок 3) и гидратной формой. В равновесной системе в воде [a]D= + 52,7°.
CHO
½
HCOH
½
HOCH
½
HCOH
½
HCOH
½
CH2OH
Рисунок 3 (альдегидо-D-глюкоза)
L-глюкоза
L-глюкоза получена синтетически, восстановлением лактона L-глюконовой кислоты. a-L-глюкоза — кристаллы tпл 142-143°С [a]D= - 95,5° (в воде) и - 51,4° (равновесная система в воде). Химические свойства L-глюкозы такие же, как у D-глюкозы.
Нахождение в природе
В особом виде глюкоза содержится почти во всех органах зелёных растений. Особенно её много в виноградном соке, поэтому глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы с фруктозой.
В организме человека глюкоза содержится в мышцах, в крови (0.1 - 0.12 %) и служит основным источником энергии для клеток и тканей организма. Повышение концентрации глюкозы в крови приводит к усилению выработки гормона поджелудочной железы — инсулина, уменьшающего содержание этого углевода в крови. Химическая энергия питательных веществ, поступающих в организм, заключена в ковалентных связях между атомами. В глюкозе количество потенциальной энергии составляет 2800 кДж на 1 моль (то есть на 180 грамм).
Получение
Первый синтез глюкозы из формальдегида в присутствии гидроксида кальция был произведён А. М. Бутлеровым в 1861 году:
O
// Ca(OH)2
6H—C ¾¾® C6H12O6
\\
H
Глюкоза может быть получена гидролизом природных веществ, в состав которых она входит. В производстве её получают гидролизом картофельного и кукурузного крахмала кислотами.
H2SO4, t
(C6H10O5)n + nH2O ¾¾® nC6H12O6
Полные синтезы глюкозы, осуществлённые, исходя из диброма кролеина, а также из глицеринового альдегида и диоксиацетона, имеют лишь теоретический интерес.
В природе глюкоза наряду с другими углеводами образуется в результате реакции фотосинтеза:
хлорофилл
6CO2 + 6H2O ¾¾¾® C6H12O6 + 6O2 - Q
В процессе этой реакции аккумулируется энергия Солнца.
Применение
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 ¾® 6H2O + 6CO2 + 2800 кДж
Этот процесс протекает ступенчато, и поэтому энергия выделяется медленно.
Глюкоза также участвует во втором этапе энергетического обмена животной клетки (расщепление глюкозы). Суммарное уравнение выглядит так:
C6H12O6 + 2H3PO4 + 2АДФ ¾® 2C3H6O3 + 2АТФ + 2H2O
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке , она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и гликоновых кислот, для синтеза ряда производных сахаров и т.д.
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
Физические свойства
Глюкоза — бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. Из водного раствора она выделяется в виде кристаллогидрата C6H12O6 · H2O. По сравнению со свекловичным сахаром она менее сладкая.
Химические свойства
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами:
| Свойства, обусловленные наличием в молекуле | Специфические свойства | |
| гидроксильных групп | альдегидной группы | |
| 1. Реагирует с карбоновыми кислотами с образованием сложных эфиров (пять гидроксильных групп глюкозы вступают в реакцию с кислотами) | 1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”): CH2OH(CHOH)4-COH + Ag2O® CH2OH(CHOH)4-CO2H + 2Ag¯ |
Глюкоза способна подвергаться брожению: а) спиртовое брожение C6H12O6®2CH3-CH2OH+ CO2 б) молочнокислое брожение C6H12O6®2CH3-CHOH-COOH молочная кислота |
|
2. Как многоатомный спирт реагирует с гидроксидом меди (II) c образованием алкоголята меди (II) |
2.Окисляется гидроксидом меди (II) (с выпадением красного осадка) 3. Под действием восстановителей превращается в шестиатомный спирт |
в) маслянокислое брожение C6H12O6®C3H7COOH + 2H2 + 2CO2 масляная кислота |
