Жидкостное химическое травление
Преодоление короткодействующих сил в амфорном твердом теле сопровождается ростом энтропии. Небольшие дефекты, такие, как напряжение, деформация, примесные уровни, также оказывают влияние на скорость травления. В кристаллическом кремнии скорость травления плоскостей с малыми индексами Миллера определяется числом свободных связей и кристаллографической ориентацией (табл. 2).
Таблица 2. Влияние ориентации на травление кремния.
| Кристаллографическая плоскость | Относительное число свободных связей | Относительная скорость травления |
| (111) (110) (100) | 0.58 0.71 1.00 | 0.62 0.89 1.00 |
Переход металла или кремния в растворимое состояние включает в себя ионизацию металла (определяемую потенциалом ионизации) и перенос электрона к соответствующему восстановителю с высоким сродством к электрону
М(тв.) ®Мn+(ж.)+ne. (4)
Реакция эта трехстадийная:
М(тв.) ®М(газ) сублимация, (5)
М(газ) ® Мn+(газ)+ne ионизация, (6)
Мn+(газ)+Н2О ® Мn+(ж.) гидратация. (7)
Изменение энтальпии при сублимации и ионизации положительно (эндотермические реакции), но гидратация экзотермична (отрицательное DН). При газофазном травлении для распыления металла путем его сублимации кинетическая энергия частиц травителя (энергия травления) должна передаваться металлу из газовой фазы. При погружении металлического образца в раствор, содержащий его собственные ионы (уравнение 4), ионы металла переходят в раствор (рис. 5), и образец приобретает отрицательный заряд. Метал образует, таким образом, свой собственный анод. и ионы Мn+ притягиваются к нему, формируя двойной электрический слой (слой Гельмгольца). разность потенциалов в нем называется

Рис. 5. Двойной слой Гельмгольца на границе металла в равновесии с ионами металла в жидкой фазе (М+) и анионами (Х-).
абсолютным электродным потенциалом. Стандартные окислительные и восстано-вительные потенциалы можно найти в литературе по электрохимии. На катоде происходит уравновешиваю-щее окисление, и катодную реакцию в растворе можно записать следующим образом:
ne+ Xn- ®Xn. (8)
итоговое приращение свобод-ной энергии, DF, составляет
DF=-nФDЕ, (9)
где DЕ есть разность анодного и катодного потенциалов, а
Ф-число Фарадея. Величина изменения свободной энергии зависит от:
1) чистоты металла, его кристаллической структуры, наличия напряжений, метода осаждения и состава примесей;
2) активности ионов металла в растворе;
3) ионной силы электролита;
4) температуры;
5) состава растворителя.
При травлении диэлектриков переноса электронов не происходит, и реакции в этом случае имеют кислотно-основный характер:
SiO2+6HF ®H2SiF6+2H2O, (10)
SiO2+CF4(газ) ®SiF4+CO2. (11)
Si¾O-связь заменяется связью Si¾F. Поскольку энергии связей Si¾O и Si¾F близки, знак изменения энтропии определяет, пройдет реакция или нет.
Общие принципы кинетики травления.
Гетерогенные твердофазные реакции затрагивают различные разделы химии, механики и физики. Типичный процесс включает в себя следующую последовательность реакций:
1) перенос реагента;
2) адсорбция реагента DНads;
3) реакция на поверхности DF;
4) десорбция продуктов DНvap;
5) перенос продуктов.
Самый медленный этап определяет скорость реакции. В реакциях низшего порядка
Скорость=k нулевой порядок, (12)
Скорость=kE первый порядок. (13)
скорость зависит от концентрации травителя (Е) только в случае реакции первого порядка. При выборе той или иной реакции травления стараются остановиться на процессе с наименьшим количеством параметров и преимущественно линейными скоростями травления. Желательно также иметь возможность изменения анизотропии регулированием физических параметров и высокую селективность процесса (т. е. отсутствие воздействия травителя на резист или слой, находящийся под стравливаемой пленкой). В реакциях нулевого порядка слабое обеднение травителя несущественно. Однако в реакциях первого порядка мы не имеем достаточного избытка травителя, и он может сильно истощиться при загрузке десяти или более пластин. В реакциях простого порядка зависимость толщины стравленной пленки (или логарифма толщины) от времени линейная. Поэтому окончание реакции может контролироваться и точно определяться экстраполяцией.
Рассмотрим механизм переноса для двух основных типов реакций - диффузионно-контролируемых и ограниченных скоростью реакции. Вообще говоря, в процессе травления могут быть вовлечены все три агрегатных состояния вещества:
1) твердая фаза ® скрытая химическая энергия и физическая структура пленки;
2) жидкая фаза ® перенос ионов в жидком диэлектрике, обладающем высокой вязкостью;
3) газообразная фаза ® хемосорбция, рекомбинация, ионизация и средний свободный пробег газовых частиц при пониженном давлении.
Феноменологический механизм травления.
Переход от твердой фазы к жидкой или газообразной
твердая пленка+ травитель ¾k® продукты (14)
зависит от диффузии взаимодействующих веществ
SiO2(тв.)+6HF(жидк.) ® H2SiF6+2H2O, (15)
SiO2+CF4 ® SiF4+CO2. (16)
Пусть r есть соотношение молярных объемов
r=(m/d)/(M/D), (17)
где m и М - молекулярные веса продукта и травителя, а d и D - соответствующие плотности. Тогда, если r>1 (как при травлении стекла), продукт не покрывает полностью твердую поверхность (рис.6). Поскольку продукт не препятствует проникновению травителя, скорость травления определяется скоростью реакции травителя с твердой поверхностью [k в уравнении 14]. Энергии активации при этом порядка 7 - 20 ккал/моль. В случае r<1 травитель не имеет свободного доступа к поверхности и должен диффундировать сквозь барьерный слой (рис. 7) и слой Гельмгольца необходимо учитывать также присутствие электрического поля (рис.5).
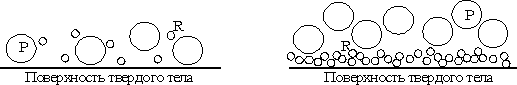
Рис. 6. Продукт (Р) не плотно покрывает поверхность, и реагент (R) имеет к ней доступ.
Рис. 7. Продукт (Р) полностью покрывает травящуюся поверхность и блокирует доступ к ней реагента (R).
Основные диффузионные модели были разработаны Фиком. Фундаментальным является предположение о том, что процессы диффузии и теплопроводности описываются одним и тем же типом уравнений. На поверхности твердого тела существует граница концентрации (рис. 8). Количество вещества dM, диффундирующее через поперечную площадку S за время dt, пропорционально S и, исходя из размерности dM, градиенту концентрации dC/dx в точке x на поверхности твердого тела площадью S
