Кровь
Лимфоциты (24%) образуются в тимусе (вилочковой железе) и лимфоидной ткани из клеток предшественниц, поступающих из костного мозга. Имеют округлую форму и содержат очень мало цитоплазмы. Способность к амебоидным движениям ограниченна. Главная функция — индукция иммунных реакций или участие в них (образование антител, отторжение трансплантата, уничтожение опухолевых клеток). Продолжительность жизни варьирует от нескольких дней у грызунов до десяти и более лет у человека. (Грин и др., 1990)
1.3 Кровяные пластинки
Кровяные пластинки представляют собой фрагменты клеток, имеющие неправильную форму, окруженные мембранной и обычно лишенные ядра. Они образуются из крупных клеток костного мозга, называемые мегакариоциты. Играют важную роль в инициации свёртывания крови. В 1 мл крови содержится около 250 000тромбоцитов.
В сосудистой крови пластинки существуют около 9—10 суток, после чего происходят их фагоцитоз, главным образом макрофагами селезенки.
Тромбоциты имеют важнейшее значение в обеспечении основных этапов Остановки кровотечения — гемостаза. На месте повреждения эндотелия стенки сосуда и обнажения базальной мембраны происходит оседание и агрегация пластинок. По следующая их активация сопровождается изменением формы (пластинки становятся шаровидными) и выделением ряда соединений, содержащихся в гранулах (тромбоцитарные факторы), которые ускоряют агрегацию пластинок. Кровяные пластинки крови кроликов выделяют значительное количество гистамина. В результате агглютинации все новых и новых пластинок образуется сгусток (белый тромб), препятствующий выхождению форменных элементов крови из поврежденного сосуда. Вследствие изменения поверхности кровяных пластинок активируются факторы свертывания, находящиеся в плазме крови, которые приводят к появлению нерастворимого фибрина, заполняющего пространства между коагулированными пластинками. В последующей ретракции кровяного сгустка имеет значение содержащийся в пластинках тромбостенин (сократительный белок). (Александровская, 1987)
Глава 2. Методы исследования клеточного состава крови.
2.1 Метод подсчета количества эритроцитов.
Наиболее распространен классический микроскопический метод подсчета клеток в камере Горяева.
Принцип: Подсчет эритроцитов под микроскопом в определенном количестве квадратов счетной сетки с последующим пересчетом на 1 мкл крови, исходя из объёма квадратов и разведения крови.
Ход определения: Исследуемую кровь разводят в 200 раз, для чего в пробирку с 4 мл 0,9% раствор хлорида натрия добавляют 20 мкл крови. Кончик пипетки вытирают фильтровальной бумагой или марлей, и кровь выдувают на дно пробирки. Пипетку тщательно промывают в верхнем слое жидкости, содержимое пробирки перемешивают и оставляют стоять до момента подсчета. К счетной камере притирают шлифовонное стекло и заполняют ее разведенной кровью. Предварительно несколько раз тщательно встряхивают содержимое пробирки, затем стеклянной или пластиковой пастеровской пипеткой (Deltalab) или стеклянной палочкой отбирают каплю разведенной крови и подносят ее к краю покровного стекла, следя за тем, чтобы она равномерно без пузырьков воздуха заполнила всю поверхность камеры с сеткой, не затекая в бороздки. Заполненную камеру оставляют в горизонтальном положении на 1 мин (для оседания эритроцитов).
Подсчет эритроцитов производят в 5 больших квадратах, разделенных на 16 малых, т.е. в 80 малых квадратах. Рекомендуется считать клетки в квадратах сетки, расположенных по диагонали. Для того чтобы не считать одни и те же эритроциты, лежащие на линиях, принято считать клетки только на определенных двух линиях (например, на левой и верхней).
Расчет количества эритроцитов в 1 мкл крови производят, исходя из разведения крови (200), числа сосчитанных квадратов (80) и объема 1 малого квадрата (1/4000 мкл), по формуле:
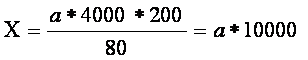
где Х - число эритроцитов в 1 мкл крови; а - число сосчитанных эритроцитов.
Эритроциты рекомендуется считать в течение 2-З часов после взятия крови. При гемолитических и мегалобластных анемиях - сразу после взятия, так как эритроциты легко разрушаются.
Ручные методы подсчета клеток чрезвычайно трудоемки и не всегда дают достаточно точные результаты, так как при визуальном подсчете постоянно присутствует субъективный фактор. Кроме того, малейшие отклонения от правил подготовки камеры и подсчета клеток влияют на конечный результат исследования. Вместе с тем, эти методы не требуют сложного оборудования, реактивов и могут быть применены практически в любых условиях.
Основными источниками ошибок при подсчете эритроцитов являются:
•Неточное взятие крови в пипетку.
•Образование сгустка, поглощающего часть клеток и занижающего результат исследования.
•Недостаточное перемешивание содержимого пробирки перед заполнением камеры.
•Неправильная подготовка камеры: недостаточное притирание покровных стекол; неравномерное заполнение камеры, образование пузырьков воздуха.
•Подсчет эритроцитов сразу после заполнения камеры, не выжидая 1 минуту.
•Подсчет меньшего, чем требуется по методике, количества квадратов.
•Плохо вымытые камера, пробирки, пипетка, капилляр для взятия крови; недостаточно просушенные пробирки и пипетки.
• Использование недоброкачественного разводящего раствора. (Луговская и др., 2001)
2.2 Метод подсчета количества лейкоцитов.
Определение количества лейкоцитов в счетной камере: Подсчет лейкоцитов под микроскопом проводят после лизирования эритроцитов в 100 больших квадратах счетной сетки и пересчитывают на 1 л крови, исходя из объема квадратов и разведения крови. Подсчет лейкоцитов должен быть произведен в течение 2-4 ч после взятия крови.
Реактивы: 3-5% раствор уксусной кислоты, подкрашенный несколькими каплями раствора метиленового синего (для окраски ядер лейкоцитов). Раствор голубого цвета, длительно годен к употреблению.
Ход определения: В пробирку с 0,4 мл уксусной кислоты набирают из пальца 20 мкл крови (разведение 1:20). Можно использовать стабилизированную антикоагулянтом венозную кровь. Выдувают кровь из пипетки на дно пробирки, затем тщательно перемешивают, повторно ее набирая и выдувая. Заполненную камеру оставляют в горизонтальном положении на 1 мин (для оседания лейкоцитов). Лейкоциты подсчитывают в 100 больших квадратах с малым увеличением (окуляр 10х, объектив 8х). Для большей точности счет лейкоцитов проводят по всей сетке в больших квадратах (неразделенных на малые квадраты и полосы), начиная с левого верхнего угла сетки. Для лучшего контрастирования затемняют поле зрения, опуская конденсор и закрывая диафрагму.
Расчет числа лейкоцитов проводят по формуле:
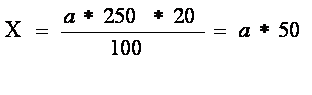
![]()
![]()
