Кристаллы в природе
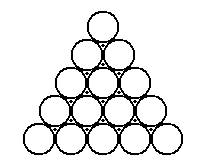
рис. 13
Шары второго слоя, для того чтобы они легли наиболее плотно, должно быть помещены в лунки первого слоя. Заполнить все лунки шарами того же самого размера нельзя, поэтому лунки заполняются через одну. Предположим, лунки отмеченные крестиком, остались пустыми, а лунки, отмеченные точками, заполнены шарами, очевидно, характер плотной упаковки не изменился бы, если бы шарами заполнили лунки, отмеченные крестиком.
Плотную упаковку из трёх слоёв можно сделать двумя различными способами. Действительно, чтобы получить плотнейшую упаковку, мы должны укладывать шары третьего слоя в лунки второго слоя. Однако шары третьего слоя при этом можно расположить либо так, что центры их будут лежать над лунками первого слоя, либо так, чтобы центры их лежали над центрами шаров первого слоя. Эти две трёхслойные постройки имеют одинаковую плотность упаковки, но структурно они отличаются друг от друга. Первой из них соответствует гранецентрированная кубическая элементарная ячейка, второй - гексанальная. При этом каждый атом, находящийся внутри упаковки, имеет 12 соседей.
2.3. Структура атомных кристаллов
Молекулярные, ионные и металлические кристаллы имеют плотноупакованные структуры вследствие того, что силы связи имеют симметричный характер. Кроме того, для этих сил не существует предельного числа атомов, на которые они могут действовать.
Ковалентные связи имеют совершенно другой характер. Они определяют число возможных «соседей» атома в кристалле и носят, кроме того, направленный характер. Например, атом углерода в кристалле может иметь только четырёх соседей, ибо он может образовывать только четыре ковалентные связи с окружающими его атомами. Кроме того, электронные облака валентных электронов имеют определённое расположение в пространстве; при «обобществлении» электронов электронные облака, частично перекрываясь, выстраиваются в цепочку и вынуждают атомы занять вполне определённое положение в пространстве. В результате каждый атом углерода оказывается в вершине правильного тетраэдра. Таким образом, структура атомных кристаллов не является плотноупакованной. Она определяется числом и видом ненасыщенных связей атомов.
2.4. Полиморфизм
Ни у кого не вызывает удивления тот факт, что разные вещества, имея различный химический состав, обладают весьма отличными друг от друга свойствами. Гораздо удивительнее то, что некоторые вещества, обладая, весьма различными свойствами, имеют одинаковый химический состав. Возьмём, например, олово. Это металл с характерным блеском, белого цвета, ковкий, обладающий, как и все металлы, хорошей электропроводностью и теплопроводностью. И рядом какое-то порошкообразное вещество серого цвета. Кажется, что между ними общего? А между тем химический анализ показывает, что этот порошок тоже олово.
Или алмаз - одно из самых твёрдых веществ, диэлектрик. Искусные руки ювелира превращают его в бриллиант, сверкающий драгоценный камень, играющий всеми своими гранями. Что общего у него с графитом - черным, легко расслаивающимся, электропроводным? А между тем химический анализ показывает, что графит, как и алмаз, представляет собой углерод в чистом виде.
Отличие алмаза от графита, серого олова от белого объясняется различием их кристаллических структур. У алмаза пространственная решётка объёмная, у графита - плоская, слоистая.
алмаз графит
Свойства веществ иметь две различных кристаллические структуры называются полиморфизмом.
Полиморфизм присущ практически все веществам. При одних условиях (температура и давления) энергетически выгодны одни структуры, при других - другие. Так, например, белое олово при низких температурах превращается в серое. Полиморфные превращения некоторых веществ возможны лишь при очень высоких давлениях.
2.5. Энергия связи молекул в кристалле
Рассмотрим взаимодействие двух частиц. На большом расстоянии частицы практически не взаимодействуют между собой. При сближении атомов появляются как силы притяжения между ними, так и силы отталкивания. Силы притяжения и силы отталкивания по-разному зависят от расстояния r между частицами. При уменьшении расстояния между частицами силы отталкивания возрастают быстрее, чем силы притяжения. На рисунке 16 линиями 1 и 2 изображена зависимость этих сил от расстояния между этими частицами. Силы притяжения действуют между разноимёнными зарядами и потому являются отрицательными, силы отталкивания действуют между одноимёнными зарядами и являются положительными. Линия 3 изображает зависимость результирующей этих сил от расстояния между частицами. результирующая сила взаимодействия вначале проявляет себя как сила притяжения. На расстоянии r0, равном приблизительно сумме радиусов молекул, сила отталкивания равна силе притяжения, и результирующая сила становится равной нулю. При дальнейшем сближении молекул результирующая сила является силой отталкивания и возрастает с уменьшением расстояния очень быстро.
Зная зависимость характера сил связи от расстояния, можно установить зависимость потенциальной энергии взаимодействия частиц от расстояния. При бесконечно большом расстоянии между частицами потенциальная энергия равна нулю. При сближении частиц надо учитывать действующую между ними силу притяжения. Работа этой силы положительна, она влечёт за собой увеличение кинетической энергии частиц и уменьшение потенциальной энергии их взаимодействия. Так происходит до расстояния r = r0 . При дальнейшем уменьшении расстояния между частицами силы притяжения будут преобладать над силами отталкивания (рис14).
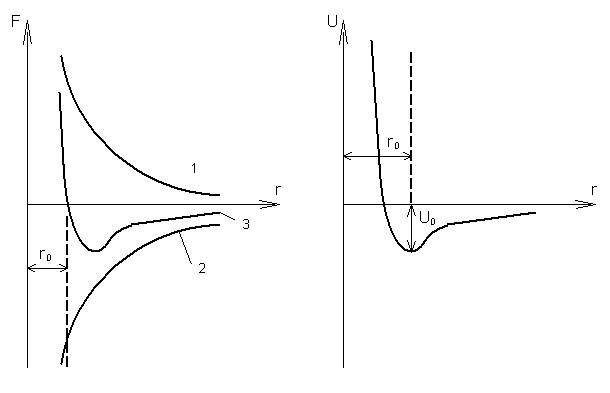
рис. 14 рис. 15
Силы отталкивания, действуя в направлении, противоположном движению частицы, совершают отрицательную работу, в результате чего потенциальная энергия взаимодействия возрастает, причём очень резко. В точке r = r0 потенциальная энергия имеет минимальное значение, а сила взаимодействия равна нулю.
Кривая потенциальной энергии взаимодействия двух частиц изображена на рисунке 15.
В кристалле все частицы находятся на таких расстояниях друг от друга, которые соответствуют минимуму их потенциальной энергии. Кроме того, частицы обладают кинетической энергией теплового движения. Для того чтобы разорвать силы связи между двумя частицами, надо совершить работу, равную U0. величину U0 называют энергией связи двух частиц.
Знания энергии связи частиц позволяет объяснить, почему при одной и той же температуре одни вещества находятся в твёрдом, другие- в жидком, а третьи- в газообразном состоянии. Известно, что для одноатомных молекул энергия теплового движения Е=3/2RТ, где R- постоянная Больцмана; Т - абсолютная температура. Если при данной температуре энергия теплового движения гораздо больше энергии связи, вещество будет находиться в газообразном состоянии. Если же энергия теплового движения меньше энергии связи, то вещество находится в твёрдом состоянии. В жидком состоянии энергия связи и энергия теплового движения частиц имеют одинаковый порядок.
