Молокосвертывающие ферментные препараты, используемые в сыроделии
Гидролиз других, чем χ -казеин, казенное молокосвертывающими энзимами протекает во время созревания сыров. Исключением являются твердые сыры с высокими температурами II нагревания и с плавлением сырной массы, во время выработки которых молокосвертывающие энзимы полностью или частично разрушаются. Участие молокосвертывающих энзимов в протеолизе во время созревания сыра необходимо для формирования органолептических показателей созревающих сыров, но количественные и/или качественные отклонения от нормального хода протеолиза вызывают пороки вкуса и консистенции. Под нормальным протеолизом в сыроделии понимают протеолиз под действием химозина при характерных для сыра условиях.
Более высокая общая протеолитическая активность молокосвертываюших энзимов по сравнению с химозином, как правило, оказывает отрицательное влияние на качество сыров, особенно с длительными сроками созревания. Например, потери молочного жира с сывороткой были выше, а плотность сгустка и качество сыра Чеддер ниже при использовании для свертывания молока пепсина вместо химозина. Однако сыры, вырабатываемые с кристаллическим химозином, имеют менее выраженный вкус и медленнее созревают, по сравнению с сырами, вырабатываемыми из этого же молока и по этой же технологии, но с сычужным порошком. Следовательно, общая протеолитическая активность молокосвертывающих энзимов в определенной степени необходима для получения сыров высокого качества.
Атака химозином χ-казеинов направлена на связи, включающие фенилаланин или лейцин. Первичная атака на χ-казеин направлена на связи Фен24-Фен25 или Фен24-Вал25 с образованием пептида άsl-І казеина. Дальнейший протеолиз может идти в растворе и сыре с последовательным образованием пептидов II, III, IV и так до XX. Под действием химозина и свиного пепсина из
άs-казеина образуется άsl пептид, но этот пептид далее расщепляется только химозином.
Гидролиз α- и β-казеинов идет с гораздо более низкой скоростью, чем χ-казеина, но благодаря длительности созревания и участия протеолитических энзимов микрофлоры закваски к концу созревания άsl -казеин и часть β-казеина бывают расщеплены. Пептиды, получающиеся в результате гидролиза казеинов молокосвертывающими энзимами, более доступны, чем исходный казеин, для протеолитических энзимов молочнокислой микрофлоры, которые играют главную роль в созревании твердых сыров. Участие в созревании, т.-е. в формировании характерных для сыров органолептических показателей, - вторая функция молокосвертывающих энзимов в сыроделии.
Из молокосвертывающих энзимов по общей протеолитинеской активности ближе всего к химозину стоит говяжий пепсин, свиной пепсин обладает более высокой общей протеолитической активностью; наименее пригоден для сыроделия куриный пепсин . Однако по другим данным, белый рассольный сыр, выработанный с цыплячьим пепсином или его смесью с реннетом, ничем не отличались от контрольных, выработанных только с реннетом, кроме более высокого содержания сухих веществ и общего азота.
Физико-химические факторы влияют как на скорость катализируемой реакции, так и на стабильность самого энзима, причем характер этого влияния на каждый процесс различается для разных энзимов. Протеолитическая активность энзимов в сырах может существенно отличаться от их активности в жидких средах. Так, сыры из молока, свернутого свиным пепсином, имеют удовлетворительные характеристики, потому что свиной энзим почти полностью инактивируется во время выработки сыров, и его высокая общая протеолитическая активность в сырах не реализуется .
Степень участия молокосвертывающих энзимов в созревании зависит от того, сколько их остается в сыре. Количество химозина, остающегося в сыре, увеличивается при снижении рН сыворотки и сырной массы.
Стабильность молокосвертывающих энзимов зависит от ионной силы среды, температуры, продолжительности выдержки и концентрации энзимов . Пепсин и химозин автолизируются при величине рН, оптимальной для их общей протеолитической активности. Плесневые протеиназы стабильны при рН до 2,5.
Общим свойством молокосвертывающих энзимов является снижение общей протеолитической активности при рН среды выше оптимального уровня. Одной из причин этого является инактивация энзимов при высоком рН. Скорость инактивации зависит от вида энзима (рис. 3). Так, говяжий пепсин начинает инактивироваться после 20-минутной выдержки только при рН выше 6,4, а при рН 7,0 сохраняет более трети исходной активности. В то же время свиной пепсин после 20-минутной выдержки при рН 6,4 теряет свыше 50% исходной активности, а при рН 7,0 почти моментально полностью инактивируется. Для свертывания молока с рН 6,6 за 5 мин, требуется одинаковая масса говяжьего и свиного пепсина, а при свертывании за 20 мин, свиного пепсина требуется в 2,5 раза болыне, чем говяжьего. Быстрая инактивация свиного пепсина в слабокислой среде, какой является молоко, является главным недостатком его как молокосвертывающего энзима.
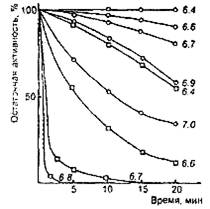
Зависимость устойчивости бычьего (о) и свиного (□) пепсина от рН при 35 ºС
Оптимальный рН для гидролиза χ-казеина химозином равен примерно 6,0, однако в интервале рН от 5,6 до 6,4 разница в скорости реакции невелика; активность снижается при рН выше 6,5 с несколько меньшей скоростью, чем для говяжьего пепсина (рис. 4). В интервале рН 6,6-6,7, характерном для молока в начале выработки сыра, скорость гидролиза χ-казеина химозином остается достаточно высокой. Куриный пепсин, гастриксин, фромаза стабильны в диапазоне рН, характерном для выработки и созревания сыра .
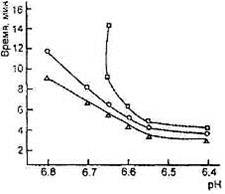
Зависимость моло-косвертывающей активности фер-ментов от рН (о- бычий пепсин, ∆'-реннин, □ - свиной пепсин)
Молокосвертывающие энзимы различаются по отношению к температуре. Изменение молокосвертывающей активности фромазы и сычужного порошка в зависимости от температуры показано на рис.4 (по материалам фирмы «Гист-Брокадес»). Отношение к температуре говяжьего пепсина почти такое же, как у сычужного порошка. В порядке возрастания устойчивости к нагреванию молокосвертывающие энзимы располагаются следующим образом: свиной пепсин, говяжий пепсин, химозин, фромаза и М. pusillus протеазы
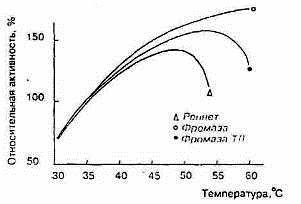
Рисунок 5 Влияние температуры на активность реписта и фромазы
Устойчивость к нагреванию понижается при повышении рН. Молокосвертывающая активность сычужного порошка максимальна при 45° С, чистого пепсина - при 35° С.(рис.5)
Желудочные протеазы млекопитающих показывают различную чувствительность к мочевине: пепсин к ней устойчив, химозин нет. Эти различия используют для их идентификации.
Обработка молока для выработки сыра 0,01-0,15% перекиси водорода повышает активность молокосвертывающих энзимов и микрофлоры закваски, увеличение дозы перекиси до 0,03-0,15% оказывает ингибирующее действие.
