Акридон. Его получение, свойства и применение
Способы получения. Несмотря на то, что акридин содержится в каменноугольной смоле, его производные и сам акридин получают синтетически из производных бензола.
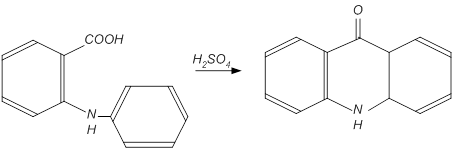
1. Наиболее общим способом получения акридина является циклизация о-анилинобензойной кислоты. Замыкание цикла может быть достигнуто с помощью серной кислоты, и в этом случае образуется акридон. Он может быть восстановлен амальгамой натрия в дигидроакридин (акридан), который затем окисляют хлоридом железа в акридин (рис. 12).
Однако чаще всего циклизацию проводят с помощью РОСl3 получая 9-хлоракридин (рис. 13).
Хлор, находящийся в мезо-положении, отличается большой реакционной способностью и легко может быть замещен алкокси-, аминогруппой или водородом. Используя замещенные о-анилинобензойные кислоты, можно получить различные производные акридина.
2. Конденсация м-фенилендиамина с муравьиной кислотой или формальдегидом позволяет получать 3- и 6-диаминоакридины:
Химические свойства. Акридин является слабым основанием, образует соли, такие, как хлорид, нитрат, пикрат и т.п., окрашенные четвертичные аммониевые соли (соединения акридиния) и N-оксид (при обработке гидропероксидом бензоила).
Акридин кипит при высокой температуре без разложения и не изменяется при сплавлении с едким кали. Окисление перманганатом частично разрушает молекулу с образованием акридиновой кислоты (2,3-хинолиндикарбоновая кислота) (рис. 14, I), однако дихромат в уксусной кислоте не разрушает циклическую структуру акридина, но превращает его в акридон (рис. 14, II) и 10,10'-диакридоннл (рис. 14, III).
Между акридином и антраценом имеется сходство. Оно выражается в способности акридина к восстановлению водородом в момент выделения (при действии натрия в водных и спиртовых растворах или при каталитическом гидрировании в 9,10-дигидроакридин. Присоединение натрия с образованием 9,10-динатриевого производного, которое со спиртом дает акридан, напоминает реакцию натрия с антраценом.
Некоторые реакции акридина напоминают реакции пиридина и его производных. Литий-алкилы присоединяются к акридину в положения 9, 10, т.е. по концам сопряженной системы. Последующий гидролиз дает производное 9,10-дигидроакридина.
Мезо-метилакридин, подобно 4-пиколину, конденсируется с альдегидами.
Производные акридина. Из производных акридина важное применение имел так называемый акрихин – 6-хлор-2-метокси-9-(1-метил-4-диэтиламино) бутиламиноакридин дихлоргидрат – желтое кристаллическое вещество с т. пл. 248—250 °С.
Акрихин широко использовался для предупреждения и лечения малярии. Он в известной степени является заменителем хинина.
Риванол — соль молочной кислоты акридинового производного следующего строения:
Эффективный антисептик. Применяется также для лечения амебной дизентерии.
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Таким образом, в предыдущих разделах рассмотрен материал, включающий различные методы получения гетероциклических соединений реакциями замыкания цикла, свойства, общую информацию, применение и получение акридина; свойства, методы синтеза и применение акридона.
Акридон был получен кипячением смеси фенилантраниловой кислоты с серной. Выход продукта составил 1,78г или 74% от теоретического выхода. Температура плавления полученного соединения составила 3440С, что полностью совпадает со справочными данными. Подобное совпадение свидетельствует о чистоте полученного продукта.
На основании собранной теоретической информации можно выдвинуть предположительный механизм данной реакции:
4. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и оборудование.
Уравнение реакции имеет вид:
Реактивы: N-фенилантраниловая кислота (С13Н11О2N, M=213 г/моль, Тпл=179-1810С) – 3г, серная кислота (Н2SО4, M=98.08 г/моль, Тпл=-13.60С, Ткип=301,30С, плотность ρ=1,85, концентрация – 0,96%) – 7мл. Карбонат натрия – 2,12г (0,02моль). Вода.
Теоретический выход вещества по взятому в недостатке реактиву, участвующему в реакции (N-фенилантраниловая кислота) составляет 2,4г.
Схема прибора:
Методика эксперимента. В круглодонной колбе емкостью 50мл приготовлен раствор 3г N-фенилантраниловой кислоты в 7мл серной кислоты (98%) и раствор нагревался на кипящей водяной бане в течение 4-х часов, после чего его вылили в 100мл кипящей воды. Раствор приливали по стенке сосуда. В течение 5мин кипятили смесь, затем желтый осадок отфильтровали, сохранив фильтрат. Влажный осадок прокипятили в течение 5мин с раствором 2,12г (0,02 моль) соды в 30мл воды, после чего его отсосали с помощью водоструйного насоса, колбы Бунзена и воронки Бюхнера и хорошо промыли водой. Затем влажный осадок был высушен на воздухе. Выход вещества составил 1,78г или 74% от теоретического. Измеренная точка плавления вещества составила примерно 3440.
5. ВЫВОДЫ
Таким образом, в данной работе рассмотрен акридон, его свойства, способы получения и применение. Приведены различные механизмы получения гетероциклических соединений реакциями конденсации. Предложен возможный механизм реакции синтеза акридона. Кипячением N-фенилантраниловой кислоты с концентрированной серной получен акридон с выходом 1,78г или 74% масс. от теоретического. Измеренная точка плавления показала сходимость полученных данных с литературными, а следовательно, очень низкую долю примесей в полученном акридоне и чистоту продукта синтеза.
6. БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Воробьев А.А. Принципы классификации и стратегия применения иммуномодуляторов в медицине. ЖМЭИ, 2002, N4, c.93-98.
2. Colonna M., Krug A., Cella M. Interferon-producing cells: on the front line in immune responses against pathogens. Curr.Opin.Immunol. 2002, 14, 373-379.
3. Джилкрист Т. Химия гетероциклических соединений. М.: Мир, 1996, с.78-109, 203-205.
4. Петров А.А., Бальян Х.В., Трощенко А.Т. Химия органических соединений, учебник для ВУЗов. С.-Пб.: Иван Федоров, 2002, с.521-524.
5. Лернер И.М., Гонор А.А., Славачевская Н.М., Берлин А.И. Указатель препаративных синтезов органических соединений. 2-ое изд., перераб. и доп. Л.: Химия, 1982.
6. Свойства органических соединений: справочник /под ред. А.А. Потехина, Л.: Химия,1984.
7. Шабаров Ю.С. Органическая химия, учебник для ВУЗов: в 2 кн. М.: Химия, 1996.
8. Земцова М.Н. Органическая химия. Указания к курсовой работе. Самар. гос. техн. ун-т. Самара, 2005, с.23.
