Алифатические предельные углеводороды и их строение
На смещение равновесия влияет и изменение давления. Так как слева направо реакция идет с уменьшением объемов газов, то повышение давления будет способствовать образованию метана, а уменьшение - разложению его[4].
6. Циклопарафины
Атомы углерода в циклопарафинах (циклоалканах), как и в алканах, находятся в sp3-гибридизованном состоянии и все их валентности полностью насыщены.
Простейший циклоалкан - циклопpопан С3Н6 - представляет собой плоский трехчленный карбоцикл.
Остальные циклы имеют неплоское строение вследствие стремления атомов углерода к образованию тетраэдрических валентных углов.

По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки "цикло" (циклопропан, циклобутан, циклопентан, циклогексан и т.д.). При наличии в цикле заместителей нумерацию атомов углерода в кольце проводят так, чтобы ответвления получили возможно меньшие номера. Так, соединение
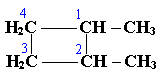
следует назвать 1,2-диметилциклобутан, а не 2,3-диметилциклобутан, или 3,4-диметилциклобутан.
Молекулы циклоалканов содержат на два атома водорода меньше, чем соответствующие алканы.
Напpимеp, бутан имеет фоpмулу С4Н10, а циклобутан - С4Н8. Поэтому общая формула циклоалканов СnH2n.
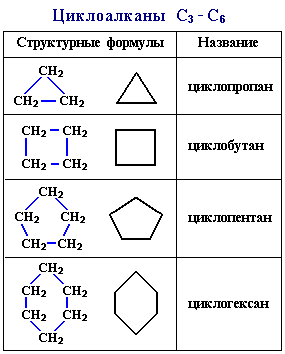
Структурные формулы циклоалканов обычно изображаются сокращенно в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле[5].
Заключение
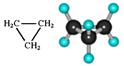
В предельных углеводородах атомы углерода находятся в первом валентном состоянии (sp3-гибpидизaция). В этом случае, как известно, все четыре гибридные орбитали в пространстве составляют геометрическую фигуру - тетраэдр (углы между осями связей С-Н равны 109° 28'). Пространственное расположение атомов в молекуле метана можно показать с помощью тетраэдрических и шаростержневых моделей. Для этого наиболее удобны объемные модели Бриглеба, которые более наглядно отражают относительные размеры атомов в молекуле. Эти модели изготовлены в соответствии с действительным соотношением радиусов атомов (в масштабе 0,05 нм = 1 см).
Основные химические превращения алканов идут только при сообщении им достаточно высокой энергии (при нагревании или облучении УФ-светом). При этом может произойти или разрыв связи С-Н с последующим замещением атома водорода на другой атом или группу атомов, или же разрыв молекулы по связи С-С. Несмотря на то что энергии этих связей равны соответственно 415-420 (для первичных углеродных атомов) и 350 кДж/моль, разрыв предпочтительнее идет по связи С-Н. Это связано с тем, что связь С-Н более доступна для реагента.
Поскольку алканы - соединения неполярные, то при разрыве связей образуются главным образом не ионы, а радикалы, т.е. этот процесс идет по гомолитическому механизму.
Список литературы
1. Максютина Н.П., Ф.Е. Каган, Л.А. Кириченко, Ф.А. Митченко. Метан. М., 2003. - 684с.
2. Роговин З.А. Основы химии. - М: Химия, 2001. - 739с.
3. Сорокин М.Ф. Химия. - М.: Химия, 2003. - 537с.
4. Химия: Справочное издание / В. Шретер. М.: Химия, 1989. - 448 с
5. Шестакова КС, Касьянова А.А. Химия. - М: Легкая индустрия, 2001,-528 с.
[1] Максютина Н. П., Ф. Е. Каган, Л. А. Кириченко, Ф. А. Митченко. Метан. М., 2003. С. 55.
[2] Шестакова КС, Касьянова А.А. Химия. - М: Легкая индустрия, 2001. С. 182.
[3] Химия: Справочное издание / В. Шретер. М.: Химия, 1989. С. 214.
[4] Сорокин М.Ф. Химия. – М.: Химия, 2003. С. 169.
[5] Роговин З.А. Основы химии.- М: Химия, 2001. С. 89.
