Анализ почв и агрохимический анализ
В лабораторной практике анализа почв используют классические химические и инструментальные методы. С помощью классических химических методов можно получить наиболее точные результаты. Относительная погрешность определения составляет 0,1-0,2%. Погрешность большинства инструментальных методов значительно выше — 2-5%
Среди инструментальных методов в анализе почв наиболее широко используются электрохимические и спектроскопические. Среди электрохимических методов находят применение потенциометрические, кондуктометрические, кулонометрические и вольтамперометрические, включающие все современные разновидности полярографии.
Для оценки почвы результаты анализов сравнивают с оптимальными уровнями содержания элементов, установленными экспериментальным путем для данного типа почв и проверенными в производственных условиях, или с имеющимися в литературе данными обеспеченности почв макро- и микроэлементами, либо с ПДК изучаемых элементов в почве. После этого делается заключение о состоянии почвы, даются рекомендации по её использованию, рассчитываются дозы мелиорантов, минеральных и органических удобрений на планируемый урожай.
Классические химические методы анализа
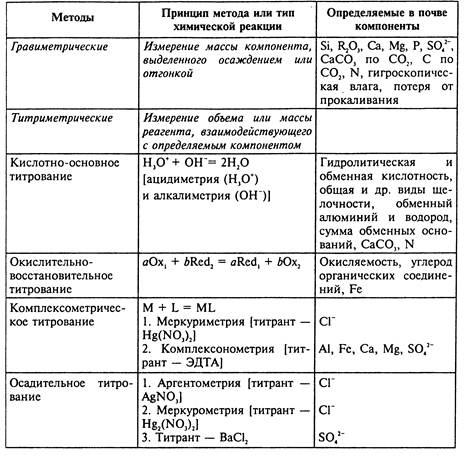
Электрохимические методы анализа
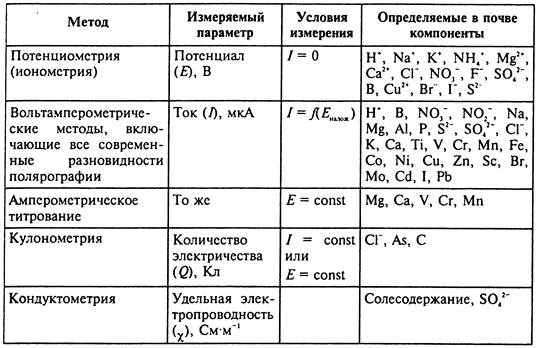
Систематизация и некоторые особенности спектроскопических методов 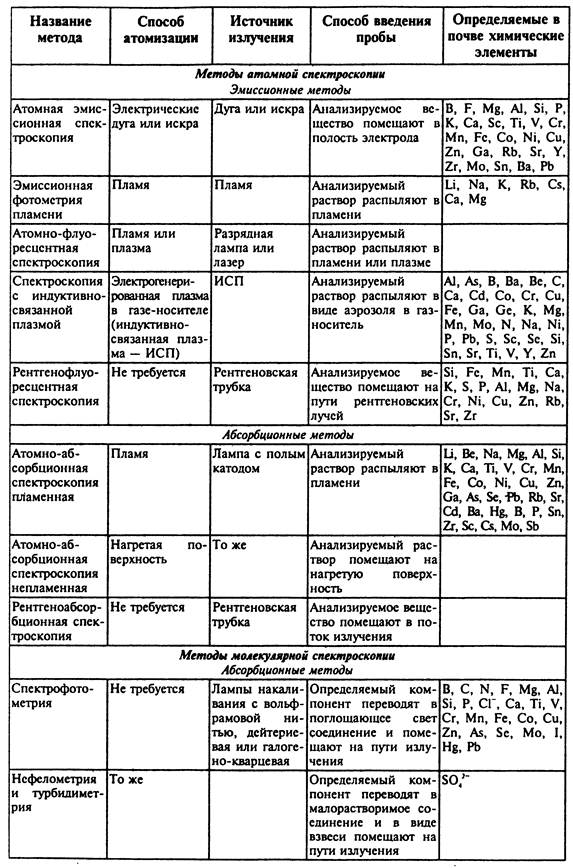
При выборе метода измерения учитываются особенности химических свойств анализируемой почвы, природа показателя, необходимая точность определения его уровня, возможности методов измерения и выполнимость требуемых измерений в условиях проведения эксперимента. В свою очередь, точность измерений обусловливается целью исследования и природной вариабельностью изучаемого свойства. Точность — собирательная характеристика метода, оценивающая правильность и воспроизводимость получаемых результатов анализа.
Соотношение уровней содержания в почвах некоторых химических элементов.

Разные уровни содержания и разные химические свойства элементов не всегда делают целесообразным применение одного и того же метода измерения для количественного определения всего необходимого набора элементов.
В элементном (валовом) анализе почв используют методы с разными пределами обнаружения. Для определения химических элементов, содержание которых превышает десятые доли процента, возможно использование классических методов химического анализа — гравиметрических и титриметрических.
Разные свойства химических элементов, разные уровни их содержания, необходимость определения разных показателей химического состояния элемента в почве делают необходимым использование методов измерения с разными пределами обнаружения.
8) Кислотность почв
Определение реакции почв относится к числу наиболее распространенных анализов, как в теоретических, так и в прикладных исследованиях. Наиболее полная картина кислотных и основных свойств почв складывается при одновременном измерении нескольких показателей, в том числе титруемой кислотности или щелочности - фактор емкости и величины рН - фактор интенсивности. Фактор ёмкости характеризует общее содержание кислот или оснований в почвах, от него зависят буферность почв, устойчивость реакции во времени и по отношению к внешним воздействиям. Фактор интенсивности характеризует силу мгновенного действия кислот или оснований на почву и растения; от него зависит поступление минеральных веществ в растения в данный отрезок времени. Это позволяет дать более правильную оценку кислотности почв, так как в этом случае учитывается общее количество ионов водорода и алюминия, находящихся в почве в свободном и поглощенном состояниях.Актуальную кислотность (рН), определяют потенциометрически. Потенциальную кислотность определяют переведением в р-р ионов водорода и алюминия при обработке почвы избытком нейтральных солей (KCl):
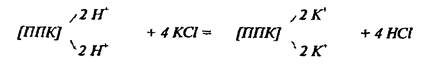
По количеству образовавшейся свободной соляной кислоты судят об обменной кислотности почвы. Часть ионов Н+ остаётся в поглощённом состоянии (образующаяся в результате р-ии сильная HCl полностью диссоциирует и избыток свободных Н+ в растворе препятствует их полному вытеснению из ППК). Менее подвижная часть ионов Н+ может быть переведена в раствор лишь при дальнейшей обработке почвы растворами гидролитически щелочных солей (CH3COONa).
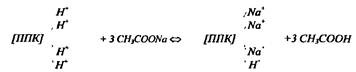
По количеству образовавшейся свободной уксусной кислоты судят о гидролитической кислотности почв. Ионы водорода при этом наиболее полно переходят в раствор (вытесняются из ППК), т.к. образующаяся уксусная кислота прочно связывает водородные ионы и реакция смещается вправо вплоть до полного вытеснения ионов водорода из ППК. Величина гидролитической кислотности равна разности между результатами, полученными при обработке почвы CH3COONa и KCl. На практике за величину гидролитической кислотности принимают результат, полученный при обработке почвы CH3COONa.
Кислотность почвы обуславливается не только ионами водорода, но и алюминия:
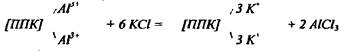
Гидроокись алюминия выпадает в осадок, и система практически ничем не отличается от той, в которой содержатся только поглощённые ионы водорода. Но если даже АlСl% останется в растворе, то при титровании
АlСl3+ 3 NaOH = А(ОН)3 + 3 NaCl
что равноценно реакции
3 НСl + 3 NaOH = 3 NaCl + 3 Н2О.Поглощённые ионы алюминия вытесняются и при обработке почвы раствором CH3COONa. В этом случае весь вытесненный алюминий переходит в осадок в виде гидроокиси.
По степени кислотности, определяемой в солевой вытяжке 0.1н. КKCl потенциометрически, почвы делятся на:
|
очень сильно кислые |
сильно кислые |
средне кислые |
слабо кислые |
близкие к нейтральным |
нейтральные |
|
рН менее 4.0 |
4.1-4.5 |
4.6 - 5.0 |
5.1 - 5.5 |
5.6-6.0 |
рН более 6.0 |
9)Определение рН, обменной кислотности и подвижного
алюминия по Соколову
Определение обменной кислотности основано на вытеснении из ППК ионов водорода и алюминия 1.0 н. раствором КKCl:
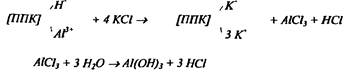
Образовавшуюся кислоту оттитровывают щёлочью и рассчитывают величину обменной кислотности, обусловленную суммой ионов водорода и алюминия. Al осаждают 3.5% р-ром NaF. В осадке образуется комплексная нейтральная соль-криолит:
