Анализ почв и агрохимический анализ
Катализаторы. Повышению температуры кипения серной кислоты и ускорению озоления способствует применение катализаторов. В различных модификациях метода Кьельдаля используют металлические ртуть и селен, сернокислый калий, сернокислую медь, перекись водорода. Использовать для сжигания в качестве катализатора хлорную кислоту отдельно или в смеси с серной кислотой не рекомендуется. Скорость окисления материала обеспечивается в этом случае не за счёт повышения температуры, а за счет быстрого выделения кислорода, что сопровождается потерями азота при озолении.
3. Отгон аммиака. После окончания сжигания колбу Кьельдаля охлаждают и в неё осторожно приливают по стенкам дистиллированную воду, перемешивают содержимое и ополаскивают горлышко колбы. Первую порцию воды наливают до горлышка и количественно переносят в круглодонную колбу емкостью 1 л. Колбу Кьельдаля еще 5-6 раз промывают небольшими порциями горячей дистиллированной воды, сливая каждый раз промывные воды в отгонную колбу. Наполняют отгонную колбу промывными водами до 2/3 объема и добавляют 2-3 капли фенолфталеина. Малое количество воды затрудняет парообразование при отгоне, а большое может вызвать переброс кипящей воды в холодильник.
4. В коническую колбу или химический стакан ёмкостью 300- 400 мл (приёмник) наливают из бюретки 25-30 мл 0.1 н. H2SO4 (с точно установленным титром), добавляют 2-3 капли индикатора метилрота или реактива Гроака (лиловая окраска). Кончик трубки холодильника погружают в кислоту. Отгонную колбу ставят на нагреватель и подсоединяют к холодильнику, проверяя герметичность соединения. Для разрушения сернокислого аммония и отгона аммиака используют 40 %-ный раствор щёлочи, взятый в таком объёме, который в четыре раза превосходит объём концентрированной серной кислоты, взятой при сжигании пробы
5. Отгонную колбу прямо на нагревателе открывают, наклоняют, в левой руке удерживают колбу и пробку холодильника. В колбу по стенке приливают отмеренное количество щёлочи так, чтобы она опустилась вся на дно колбы, и пробку холодильника быстро закрывают. Это вызвано тем, что реакция взаимодействия щелочи и сульфата аммония начинается и без нагревания, что приводит к потерям аммиака. Горлышко колбы нельзя по всей поверхности заливать щёлочью, так как пробка холодильника выскочит при кипячении.
6. Закрытую колбу осторожно и тщательно взбалтывают круговыми движениями, при этом в стакан-приёмник проскакивают первоначально пузырьки воздуха. Раствор в колбе сначала становится красного цвета, а затем темнеет, и при нагревании появляется объёмный осадок. Включают нагреватель и холодильник и приступают к отгону аммиака. Через 20-25 мин после начала отгона опускают стакан-приёмник так, чтобы раствор аммиака из холодильника стекал по стенке стакана. Кипение в отгонной колбе должно быть равномерным и достаточно интенсивным, иначе кислота из стакана будет засасываться в холодильник за счёт перепада внутреннего и наружного давления газов. Если засасывание началось, надо усилить нагрев отгонной колбы и вынуть конец трубки холодильника из раствора кислоты, для этого опустить стакан-приёмник.
7. Отгон считать законченным, когда содержимое отгонной колбы испарится до 1/3 первоначального объёма. Полноту отгона аммиака проверяют универсальным индикатором, лакмусом или реактивом Несслера, для чего берут несколько капель из холодильника на индикаторную бумагу или в пробирку, куда добавлен реактив Несслера. Он дает с аммиаком жёлтое окрашивание. Если в процессе отгона жидкость в приёмнике изменит окраску, необходимо добавить точно фиксированное количество 0.1 н. H2SO4(20 мл), так как первоначального объёма кислоты не хватило для связывания аммиака.
8. По окончании отгона, носик холодильника споласкивают дистиллированной водой из промывалки в приёмник.
9. Содержимое приёмника титруют 0.1 н. раствором едкого калия, перемешивая осторожно стеклянной палочкой, до перехода окраски метилового красного в бесцветную, а по реактиву Гроака от лиловой в светло-зелёную. Здесь интенсивность окраски зависит от количества индикатора.
Количество аммиака находят по разности между количеством кислоты в приёмнике, первоначально прилитой, и количеством кислоты, которая не связалась с аммиаком и оттитрована впоследствии щёлочью.
Расчёт
Содержание общего азота:
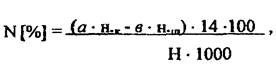
где: a - объём H2SO4 в приёмнике, мл ; н.к- нормальность H2SO4 мг-экв, b - объём щёлочи, израсходованный на титрование, мл; н.щ- нормальность щелочи, мг-экв; 14 - атомная масса азота; Н - навеска, г; 1000 - коэффициент пересчёта мг в г.
Реактивы
1. H2SO4 (d=1.84)
2.40 %-й KOH.
3. Селен металлический порошок.
4. 0.1 н. раствор H2SO4, готовится из фиксанала.
5. 0.1 н. раствор NaOH или КОН, готовится из фиксанала.
6. Индикатор Гроака, комбинированный, при рН 5.5 - чёткое изменение фиолетового цвета на зелёный.
Приготовление:
А - 0.15 г метиленового красного растворяют в 102 мл этилового спирта-ректификата;
Б - 0.05 г метиленового голубого растворяют в 5 мл дистиллированной воды. Смешанный индикатор хранят в склянке из тёмного стекла.
В) Анализ удобрений
1) Определение видов и форм некоторых минеральных удобрений
по качественным реакциям
1. Простые минеральные удобрения могут быть кристаллическими (к ним относятся все азотные, кроме цианамида кальция и все калийные) и аморфными (к ним относятся все фосфорные удобрения и известковые материалы).
2. Растворимость в воде: кристаллические удобрения заметно растворимы либо полностью растворимы. Аморфные удобрения, как правило, слабо растворимы или нерастворимы.
3. Гранулометрический состав: азотные удобрения выпускаются в гранулах и покрыты слабой легкорастворимой гидрофобной плёнкой, за исключением цианамида кальция, сульфата- и хлорида аммония; калийные - в виде крупных кристаллов белого или розового цвета (хлорид калия) или мелкокристаллических порошков с серым оттенком - все остальные. Простые фосфорные удобрения представлены матовыми гранулами серо-белого цвета различных оттенков и аморфными порошками, известковые материалы - аморфные порошки различной тонины помола, сложные и комплексные удобрения - матовыми гранулами беловато-серовато-розового оттенка.
4. В состав кристаллических удобрений входят следующие ионы, которые достаточно легко определяются качественными реакциями: NH4+ K+,. Ca2+, Na+, SO42-, NO3-, Cl-. Для открытия иона NH4+ используют реакцию удобрения со щёлочью, выделение в этой реакции аммиака при нагревании устанавливается по запаху.
NH4N03 + NaOH = NaNO3 + NH3↑ + H2О
Присутствие иона NO3- устанавливается с помощью дифениламина, который при взаимодействии с нитрат-ионом образует в растворе соединения синего цвета. Для открытия сульфат-иона используют реакцию с хлоридом бария:
![]()
Выпадает белый кристаллический осадок. Образовавшийся осадок растворяется под действием соляной и уксусной кислоты. Присутствие K+,. Ca2+, Na+ обнаруживают по окраске пламени: кусочек удобрения помещают на раскалённую деревянную пластинку и вносят в пламя горелки: калийные соли, особенно селитра, вспыхивают и окрашивают пламя в фиолетовый цвет, натриевые соли - в жёлто-оранжевый, кальциевые вспыхивают и сгорают, не окрашивая пламени.
