Взаимодействия в коллоидных системах
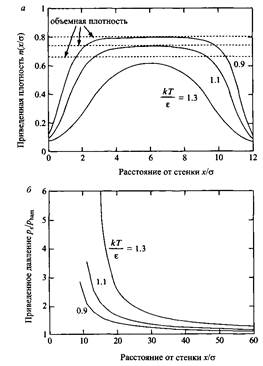
Жидкость Леннард-Джонса между двумя инертными стенками, а - Зависимость приведенной плотности от расстояния между стенками для трех значений приведенной температуры. б - Усиление притяжения вследствие понижения плотности. В подходе Гамакера при расчете притяжения ^ham плотность в зазоре принимается постоянной и равной объемной плотности
Осцилляторные силы обнаруживаются также в среде линейных алканов, но они не проявляются в среде разветвленных алканов. Подобные силы зарегистрированы между поверхностями слюды в водных растворах, но в этом случае обнаружен более короткий период осцилляции по сравнению с ОМЦТС, что объясняется разницей молекулярных размеров воды и ОМЦТС.
Гидратные силы отталкивания
Легко представить, что заряженная поверхность или поверхность, несущая противоположные заряды, при погружении в водный раствор будет связывать один или несколько слоев молекул воды, гидратирующих поверхность таким же образом, как растворенный ион формирует гидратную оболочку. Приведение таких поверхностей в контакт вызывает их дегидратацию. Можно предположить, что в результате возникают гидратные силы отталкивания.

Осцилляторные силы между поверхностями слюды в инертной силиконовой жидкости, диаметр молекул ОМЦТС составляет ~9 A
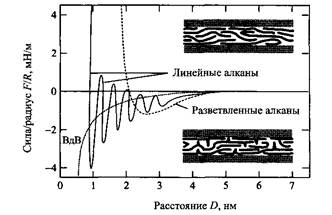
Силы, действующие между поверхностями слюды в среде линейного и разветвленного алканов
Было обнаружено очень сильное, короткодействующее взаимодействие между липидными бислоями. Расстояния, на которых проявляется это взаимодействие, лежат в диапазоне 10-30 А. Отталкивание экспоненциально уменьшается с увеличением расстояния между липидным монослоями. Для измерения соответствующей силы была использована методика, основанная на измерении осмотического давления. Аналогичным образом методом измерения поверхностных сил с помощью специального прибора были измерены силы отталкивания между поверхностями слюды. Гидратные силы отталкивания, по-видимому, действуют как между нейтральными, так и между заряженными поверхностями. Несмотря на то что поверхности слюды жесткие, а би-слойные структуры - гибкие, оба исследования дали удивительно хорошо согласующиеся результаты. Отталкивание между поверхностями слюды наблюдалось и в других жидких средах.
Проведенные эксперименты привели к интенсивным поискам теоретической интерпретации результатов. Одной из причин отталкивания предложено считать структурную поляризацию или поляризацию водородных связей на поверхности. В случае липидных бислоев механизм отталкивания может быть обусловлен возможностью волнообразных деформаций и взаимодействием отображения заряда. Недавно было высказано предположение, что липиды "выдавливаются" в растворитель; при сближении поверхностей возможность образования выступов уменьшается, что приводит к появлению отталкивания. Этот механизм близок к идее отталкивания из-за волнистости. Разница заключается главным образом в масштабе флуктуации. Исходная модель основана на "волнистости" с большой длиной волны, тогда как модель "выступов" справедлива на расстояниях, сопоставимых с молекулярными размерами.
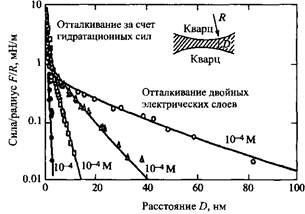
Гидратные силы отталкивания между поверхностями слюды в растворе электролита. Следует отметить, что отталкивание возникает только при концентрации соли > 1мМ.
Моделирование методом Монте-Карло обнаружило короткодействующие силы отталкивания даже для идеально гладких поверхностей. Необходимо сказать, что как гидратные силы отталкивания, так и гидрофобное притяжение, которое описано ниже, можно достаточно просто моделировать, варьируя силу взаимодействия между растворителем и поверхностью. Сильное притяжение растворитель-поверхность автоматически приводит к появлению силы отталкивания поверхность-поверхность. Если поверхности инертны, т.е. нет сил притяжения между поверхностью и растворителем, то между поверхностями действует сольватационное притяжение. В обоих случаях взаимодействие ограничено расстояниями менее 100 А.

Гидратные силы отталкивания и гидрофобное притяжение для смачиваемой и несмачиваемой стенок соответственно. Теоретические данные получены из обобщенной теории Ван дер Ваальса
Гидрофобное притяжение
Накоплено множество результатов измерений силы, действующей между гидрофобными поверхностями. Обычно для исследований используют поверхности слюды, модифицированные монослоями углеводородных или фторированных групп, обращенных к воде. Эти исследования привели к неожиданному результату: было обнаружено, что между такими поверхностями сила притяжения действует на больших расстояниях. Притяжение распространяется на сотни ангстрем. При этом притяжение нельзя объяснить силами Ван дер Ваальса в рамках подхода Гамакера. Кроме того, на него практически не влияют добавки солей. Экспериментально наблюдаемое дальнодействие невозможно объяснить аналогично тому же типу гидрофобного взаимодействия, с которым мы встречались, например, при взаимодействии двух атомов неона в воде. Хотя принято считать, что "обычное" гидрофобное взаимодействие проявляется только на близких расстояниях, реально его величина может увеличиваться по механизму уменьшения плотности.
Считается, что гидрофобное притяжение ответственно за быструю коагуляцию гидрофобных частиц в воде и играет важную роль в фолдинге белков. Однако, как и в случае гидратных сил отталкивания, теоретические разработки гидрофобных взаимодействий практически отсутствуют. Одним из возможных механизмов, способных обеспечить притяжение, может быть образование полостей, т.е. маленьких пузырьков газа, на гидрофобизованной поверхности слюды. В зависимости от условий такая кавитация вызывает увеличение силы отталкивания или притяжения. Другая возможная причина притяжения между гидрофобизованными поверхностями заключается в том, что поверхности локально не нейтральны и корреляция между положительно и отрицательно заряженными участками вызывает притяжение.
Силы деплеции
Для кристаллизации белков обычно используют полиэтиленоксид. Считается, что ПЭО вызывает силу деплеции между макромолекулами белка. Другими словами, ПЭО не может проникать в пространство между молекулами белка из-за очень сильного ограничения конформационной свободы полимерных цепей ПЭО. Накапливаясь в растворе, ПЭО создает осмотическое давление, действующее на молекулы белка. Это очень интересный механизм, в том смысле, что вводимый полимер влияет на взаимодействие между коллоидными частицами, не находясь между ними! Диапазон сил притяжения деплеции по порядку величины совпадает с радиусом инерции полимерной молекулы. Для идеального полимера радиус инерции равен г1/2, где r - степень полимеризации.
Иногда на больших расстояниях до проявления сил притяжения деплеции появляются силы отталкивания. Это явление часто называют деплеционным отталкиванием. И притяжение, и отталкивание этой природы наблюдались экспериментально и описаны теоретически.
