Гидроксикарбонильные соединения. Дикарбоновые кислоты
a-Гидроксикарбонильные соединения, как уже отмечалось, могут быть получены окислением диолов гипобромитом натрия или реагентом Фентона.
Для a-гидроксикарбонильных соединений характерна димеризация в циклические полуацетали, соответственно кетали (2,5-дигидрокси-1,4-диоксаланы):
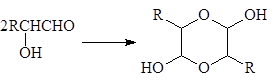 (55)
(55)
Как a-гидроксиальдегиды так и a-гидроксикетоны находятся в таутомерном равновесии с ендиолами и через такие формы могут превращаться друг в друга (перегруппировка Лобри-де Брюина - Ван-Экенштейна).
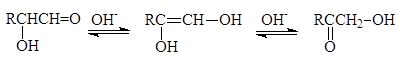 ендиолы
ендиолы
Упр. 38. Напишите реакции взаимного превращения глицеринового альдегида (2,3-дигидроксипропаналя) и 1,3-дигидроксиацетона (1,3-дигидрокси-2-пропанона) в щелочной среде.
Ендиолы имеют кислую реакцию и в щелочной среде образуют соли, называемые редуктонатами. Редуктонаты являются сильными восстановителями, поэтому в противоположность просто кетонам a-оксикетоны, обладающие восстановительными свойствами, реагируют с реактивом Фелинга. При этом сами они окисляются до 1,2-дикарбонильных соединений.
Отличительной чертой 1,4- и 1,5-гидроксикарбонильных соединений является оксо-цикло таутомерия (кольчато-цепная таутомерия), приводящая к образованию циклических полуацеталей, причем гидроксильная группа может занимать как аксиальное так и экваториальное положение:
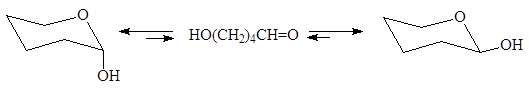
Образующиеся полуацетали являются энантиомерами и находятся между собой в равновесии.Если нет необходимости указывать конфигурацию полуацеталя пользуются волнистой линией:
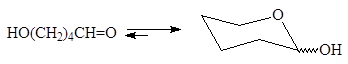
Циклические полуацетали реагируя со спиртами, могут превращаться в полные ацетали:

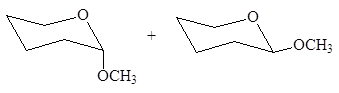 (56)
(56)
Ацетали, как известно, устойчивы в щелочной среде, но легко гидролизуются в кислой среде:
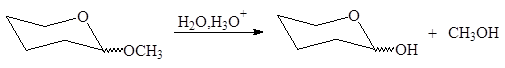 |
(57)
Дикарбонильные соединения
Как и в случае других бифункциональных производных, химические свойства диальдегидов, дикетонов и кетоальдегидов в заметной степени определяются относительным расположением функциональных групп друг относительно друга. Поэтому различают: 1,2- или a-дикарбонильные соединения, 1,3- или b-дикарбонильные соединения, 1,4- или c-дикарбонильные соединения и т.д.
a-Дикарбонильные соединения
a-Дикарбонильные соединения могут быть получены окислением альдегидов и кетонов диоксидом селена в уксусной кислоте при обычной температуре или действием на них азотистой кислотой с последующим гидролизом монооксима в разбавленной кислоте:
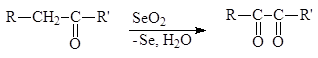
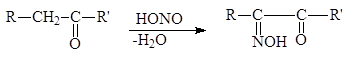
К характерным свойствам a-дикарбонильных соединений относится их способность изомеризоваться в щелочной среде в a-гидроксикислоты:
![]() (58)
(58)
гликолевая кислота
Реакции 1,3-дикарбонильных соединений
Химические свойства 1,3-дикарбонильных соединений в значительной степени определяются кето-енольной таутомерией. 1,3-Дикарбонильные соединения являются более сильными С-Н-кислотами, чем простые альдегиды и кетоны. Например, ацетилацетон (pKa = 9,0) растворим в щелочах и реагирует с натрием с выделением водорода. С солями тяжелых металлов 1,3-дикарбонильные соединения образуют очень стабильные хелатные комплексы, растворимые в органических растворителях и перегоняющиеся без разложения при обычном давлении.
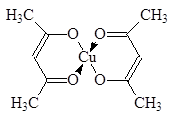
Ацетилацетонат меди
Сопряженные 1,3-дикарбонильным соединениям основания могут алкилироваться в соответствии с правилом Корнблюма как по атому кислорода, так и по атому углерода.
При нагревании с сильными щелочами 1,3-дикарбонильные соединения расщепляются с образованием кетона и кислоты:
Упр. 39. Допишите реакции:
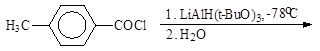 | |||
(а) (б)
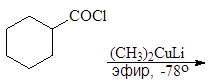 |
![]()
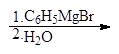
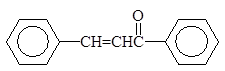 (в) (г)
(в) (г)
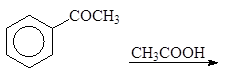 | |||
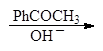 | |||
(д) (е)
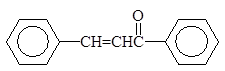 | |||||
(ж) (з)
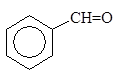 | 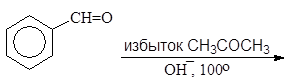 | ||||
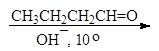 | |||||
