ИК-спектральное проявление водородных связей
2. Рассмотрим рисунок 1.
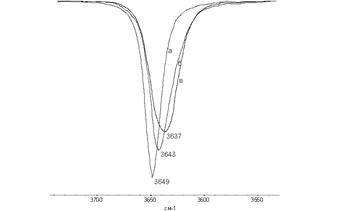
Рис.1 - Фрагменты ИК спектров растворов ионола в четыреххлористом углероде (а), в хлороформе (б) и бензоле (в).
Из рисунка видно влияние природы растворителя на способность к образованию водородной связи с ионолом. В четыреххлористом углероде водородная связь с ионолом не образуется, так как растворитель инертный в силу отсутствия протонов. С хлороформом, благодаря наличию одного протона происходит взаимодействиеполоса поглощения смещена на 6 см-1 в низкочастотную область и наблюдается уширение спектра, что также связано с образованием водородной связи. В растворе бензола также происходит образование водородной связи между растворителем и веществом, и пик еще менее острый и с более низкой оптической плотностью ИК-поглощение свободных ОН-групп, что также говорит об увеличении доли ассоциатов в растворе.
Таблица 1 - Характеристика ИК полос поглощения гидроксильных групп растворов ионола
|
Растворитель |
ν, см-1 |
Оптическая плотность ИК поглощения ОН своб. |
|
Четырёххлористый углерод (CCl4) |
3649 |
0,34 |
|
Хлороформ (CHCl3) |
3643 |
0,29 |
|
Хлористый метилен (СН2Cl2) |
3638 |
0,24 |
|
Бензол (C6H6) |
3637 |
0,23 |
|
Толуол (C7H8) |
3637 |
0,23 |
|
Кумол (C9H12) |
3643 |
0,19 |
|
Примечание: ν – частота максимума полосы поглощения в ИК спектрах растворов ионола в области валентных колебаний ОН-группы | ||
Из таблицы 1 видно, что при растворении ионола в бензоле и толуоле частота и оптическая плотность одинаковы. Возможно, это связано с недостаточной чувствительностью прибора, так как СН3-группа влияет на электронную плотность кольца за счет положительных мезомерного и индуктивного эффектов.
3. Рассмотрим рисунок 2.
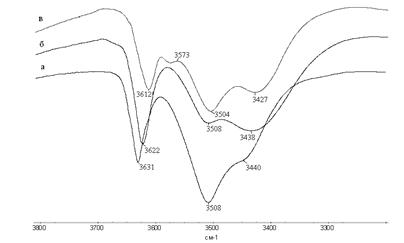
Рис. 2 – Фрагменты ИК спектров растворов БФ в четыреххлористом углероде (а), в хлороформе (б) и бензоле (в).
Таблица 2 - Характеристика ИК полос поглощения гидроксильных групп растворов БФ
|
Растворитель |
ν, см-1 |
Оптическая плотность в областях спектра ИК поглощения | |||
|
ОН (своб.) |
ОН… π связь |
ОН (внутримол.) |
ОН (межмол.) | ||
|
Четырёххлористый углерод (CCl4) |
3631, 3508, 3440 |
0.32 |
- |
0.69 |
0.31 |
|
Хлороформ (CHCl3) |
3622, 3508, 3438 |
0.46 |
- |
0.33 |
0.38 |
|
Хлористый метилен (СН2Cl2) |
3620, 3508, 3435 |
0.60 |
- |
0.42 |
0.54 |
|
Бензол (C6H6) |
3612, 3573, 3504, 3427 |
0.39 |
0.26 |
0.59 |
0.44 |
|
Толуол (C7H8) |
3612, 3573, 3504, 3437 |
0.35 |
0.29 |
0.58 |
0.40 |
|
Кумол (C9H12) |
3610, 3573, 3504, 3437 |
0.31 |
0.27 |
0.63 |
0.39 |
Из рисунка видно, что при растворении БФ в четыреххлористом углероде(а) присутствуют ОН-группы в свободном состоянии(3631 см-1), также видно, что преобладает цис-форма БФ(3508 см-1), то есть образуется внутримолекулярная водородная связь, но есть и небольшая доля транс-БФ(3440 см-1), то есть образуется межмолекулярная водородная связь. Из фрагмента спектра хлороформа (б) видно, что БФ со свободными ОН-группами уже меньше(3622 см-1), а соотношение цис- и транс-БФ примерно 1:1, то есть в хлороформе в равной степени идет образование как внутримолекулярной, так и межмолекулярной водородной связи(3508 см-1 и 3438 см-1 соответственно). В растворе бензола (в) свободные ОН-группы практически отсутствуют, появляется небольшой пик с частотой 3573 см-1 , это говорит о взаимодействии БФ с π-системой бензола и здесь вновь преобладает цис-БФ(внутримолекулярная водородная связь) и в меньшем количестве транс-БФ(межмолекулярная водородная связь). Из таблицы 2 также видно, что при растворении БФ в толуоле и кумоле также преимущественно образуется цис-БФ, в меньшей степени транс-БФ, практически отсутствуют свободные ОН-группы.
