Исследование растворимости и ионного обмена как инструмент изучения равновесий в водном растворе
Содержание:
Растворимость
1. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
2. ПРЯМОЙ МЕТОД РАСТВОРИМОСТИ
3. МЕТОД КОНКУРИРУЮЩЕЙ РАСТВОРИМОСТИ
ИОННЫЙ ОБМЕН
1. КАТИОННЫЙ ОБМЕН
2. анионный обмен
Список литературы
РАСТВОРИМОСТЬ
Измерение растворимости труднорастворимых твердых веществ в водных растворах комплексообразугощего агента — один из самых старых методов изучения равновесия в растворе. В конце прошлого столетия этим способом были исследованы молекулярные комплексы пикриновой кислоты, а несколько лет позднее прямой метод и метод конкурирующей растворимости были использованы для определения констант устойчивости комплексов ионов металлов. Этот метод был также применен для изучения равновесия в смешанных водно-органических растворителях и в системах, насыщенных по отношению к труднорастворимым жидкостям или газам.
Большинство данных по растворимости трудно интерпретировать, так как часто происходят значительные изменения состава водной фазы и, следовательно, стехиометрического произведения растворимости
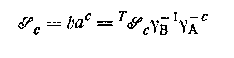
труднорастворимого комплекса ВАс; здесь T ![]() — термодинамическое произведение растворимости. Однако так же, как и в работах с гомогенными системами, для изучения растворимости можно использовать постоянную ионную среду; по методикам Эдмондса и Бирнбаумя, Кинга, Ледена и сотрудников был проведен ряд измерений растворимости с помощью растворов, в которых контролировались коэффициенты активности. Например, Нильссон нашел, что произведение растворимости иодида таллия было одинаково в 4 М растворе перхлората натрия и 4 М растворе иодида натрия. Однако значения
— термодинамическое произведение растворимости. Однако так же, как и в работах с гомогенными системами, для изучения растворимости можно использовать постоянную ионную среду; по методикам Эдмондса и Бирнбаумя, Кинга, Ледена и сотрудников был проведен ряд измерений растворимости с помощью растворов, в которых контролировались коэффициенты активности. Например, Нильссон нашел, что произведение растворимости иодида таллия было одинаково в 4 М растворе перхлората натрия и 4 М растворе иодида натрия. Однако значения ![]() для хлорида, бромида и тиоцианата таллия увеличивались с концентрацией свободного лиганда в области 0,5 М≤а≤4,0 М в 4 М ионной среде, указывая на то, что коэффициенты активности зависят от состава среды при этих условиях.
для хлорида, бромида и тиоцианата таллия увеличивались с концентрацией свободного лиганда в области 0,5 М≤а≤4,0 М в 4 М ионной среде, указывая на то, что коэффициенты активности зависят от состава среды при этих условиях.
1. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Методы для определения растворимости в широких пределах экспериментальных условий были рассмотрены Циммерманом. При изучении равновесия в водном растворе изменение растворимости в зависимости от начального состава водной фазы измеряется при постоянной температуре.
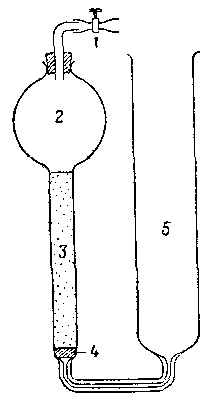
Рис. 1. Сатуратор Бренстеда — Дэписа.
1 – винтовой зажим, 2 – емкость, содержащая растворитель, 3 - колонка с тонкоразмельченным насыщающим твердым веществом; 4— пористая стеклянная прокладка; 5 - емкость, содержащая насыщенный раствор.
Равновесие между твердой фазой и раствором может быть достигнуто или встряхиванием в закрытом сосуде, или пропусканием водной фазы через сатуратор, наполненный твердым веществом; тип сатуратора, примененный Дэвисом и сотрудниками, показан на рис. 1. Равновесие следует устанавливать в термостате. Так как часто равновесие достигается медленно, следует проверять, получается ли одинаковое значение растворимости при ненасыщенной или пересыщенной начальной водной фазе, а также через различные промежутки времени. Равновесие в инертных системах [например, аммиакаты кобальта(Ш)] достигается быстрее с помощью катализатора. Иногда необходимо покрывать внутреннюю поверхность сосудов и пробок парафиновым воском или силиконом для того, чтобы избежать потерь растворенного вещества вследствие сорбции на стекле.
Твердая фаза может быть отделена от насыщенного раствора фильтрованием или центрифугированием, которые следует проводить при температуре равновесия. Особенно удобно помещение с постоянной температурой, но, если его нет, фильтрование можно легко выполнить в термостате. Например, установление равновесия и последующее разделение можно проводить в термостатированном сатураторе Дэвиса со встроенным фильтром. Если равновесие проводится в отдельных сосудах, то фазы могут быть разделены с помощью пипетки с пористым фильтром или термостатированного ультрафильтра Тиссена под давлением от 2 до 3 атм. Хотя и трудно проводить центрифугирование точно при температуре равновесия, если нет термостатирующего помещения, все же кристаллизацию из горячих растворов можно предотвратить продуванием горячего воздуха через центрифугу и с помощью подогретых пипеток для удаления водной фазы. Фазы могут иногда быть отделены более полно, если прокладка из ваты центрифугируется на поверхности твердого вещества.
Выбор аналитического метода в основном зависит от величины измеряемой растворимости. Умеренно высокие значения обычно определяют гравиметрическим или объемным методом, а низкие значения - полярографическим, колориметрическим или радиометрическим методами. Незаряженные формы могут быть иногда отделены от насыщенного раствора экстракцией. Так, растворимость углеводородных лигандов в водных растворах серебра (I) была определена спектрофотометрически после экстракции лиганда гексаном, в то время как растворимость дитизона в буферных растворах измерялась добавлением избытка радиоактивного серебра, экстрагированием дитизоната серебра хлороформом и определением активности в органической фазе.
Хотя измерение растворимости обычно включает анализ насыщенного раствора, были выполнены также эксперименты по смещению ряда растворов известной концентрации с последующим определением веса образовавшегося осадка.
2. ПРЯМОЙ МЕТОД РАСТВОРИМОСТИ
В простейшем случае измерения растворимости применяются для изучения равновесия, когда единственными формами, присутствующими в обеих фазах (кроме растворителя и ионной среды), являются формы, образованные из центральной группы В и лиганда А.
Серьезным недостатком прямого метода растворимости является потеря одной степени свободы в насыщенных растворах, кроме того, метод ограничен системами комплексов, которые являются моноядерными относительно группы, произведенной целиком от труднорастворимого вещества.
Прямой метод растворимости особенно ценен для изучения кислот слишком нерастворимых (например, дитизон), чтобы их можно было исследовать другими методами. Однако для более растворимых веществ он менее удобен и, возможно, менее точен, чем потенциометрня. Этот метод имеет, кроме того, еще один недостаток: он не дает сведений об образовании полиядерных форм.
3. МЕТОД КОНКУРИРУЮЩЕЙ РАСТВОРИМОСТИ
Если неудобно измерять растворимость ВАс, метод растворимости тем не менее может быть использован для определения констант устойчивости комплексов ВАn, при условии, что можно приготовить труднорастворимый твердый комплекс ВАС или ВАС, который содержит вспомогательную центральную группу В или лиганд А, и что можно определить независимо его произведение растворимости и константы устойчивости вспомогательного ряда комплексов ВАn. Метод конкурирующей растворимости в отличие от прямого метода в принципе может быть использован для изучения полиядерных комплексов ВqАp при условии, что начальные концентрации А и В могут меняться.
