Исследование растворимости и ионного обмена как инструмент изучения равновесий в водном растворе
ИОННЫЙ ОБМЕН
Катиониты являются полифункциональными соединениями, состоящими из высокомолекулярных анионов н простых катионов; промышленные синтетические вещества обычно являются формальдегидными или полистирольными смолами, которые содержат фенольную, сульфо- или карбоксильную группы в кислой форме или в виде соответствующей натриевой соли. Смолы не растворяются в воде и в большинстве органических растворителей. Если их привести в равновесие с раствором, содержащим ионы металла или другие катионы (например, ВАnz+ ), они могут участвовать в реакции обмена типа
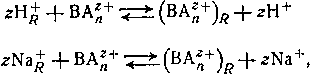
где подстрочная буква R обозначает фазу смолы. Нерастворимые амины или четвертичные аммониевые соли могут подвергаться подобным реакциям обмена с анионами в растворе, например,
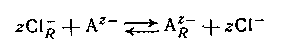
между анионным лигандом А и обменником в хлоридной форме. Большинство анионитов является несколько неустойчивыми смолами с высоким молекулярным весом, но на практике также применяются жидкие амины с умеренно низким молекулярным носом.
Из уравнений очевидно, что изучение полного распределения центральной группы В или лиганда А между ионообменииком и водной фазой может дать ценные сведения о формах, присутствующих в растворе. Еще в 1922 г. было проведено первое, хотя и безуспешное исследование комплексов металлов с помощью синтетического цеолита, но ионный обмен не применялся для изучения равновесия в растворе до конца 1945 г., когда стали легко доступными синтетические смолы. Как катиониты, так и аниониты использовались для определения природы форм, присутствующие в растворе, но обычно катиониты более пригодны для определения констант устойчивости.
1. КАТИОННЫЙ ОБМЕН
Коэффициент распределения катиона ![]() где с+ - максимальное значение n для катионного комплекса) между водной фазой и натриевой формой катионита можно выразить через константу равновесия. Таким образом, стехиометрнческая константа распределения ВАnz+ определяется формулами
где с+ - максимальное значение n для катионного комплекса) между водной фазой и натриевой формой катионита можно выразить через константу равновесия. Таким образом, стехиометрнческая константа распределения ВАnz+ определяется формулами
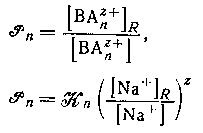 и будет постоянной при условии, что постоянны значения
и будет постоянной при условии, что постоянны значения ![]() и отношение концентрации ионов натрия в двух фазах. Последнее условие выполняется, если водная фаза содержит постоянную высокую концентрацию ионов натрия и обмен невелик. Подобным образом, если вероятен гидролиз группы В в смоле или в растворе, то достаточно использовать смолу в водородной форме и сильную кислоту в качестве фонового электролита. Использование постоянной ионной среды также обеспечивает постоянство коэффициентов активности в водной фазе.
и отношение концентрации ионов натрия в двух фазах. Последнее условие выполняется, если водная фаза содержит постоянную высокую концентрацию ионов натрия и обмен невелик. Подобным образом, если вероятен гидролиз группы В в смоле или в растворе, то достаточно использовать смолу в водородной форме и сильную кислоту в качестве фонового электролита. Использование постоянной ионной среды также обеспечивает постоянство коэффициентов активности в водной фазе.
Томпкинс и Мэйер нашли, что константа равновесия обмена между ионами лантана и аммония на смоле Дауэкс 50 достигает постоянной величины при очень низких концентрациях ионов лантана. Работы Фронеуса по ацетатным системам меди и никеля указывали на то, что при постоянной и очень малой загрузке смолы значения К зависят от концентрации свободных ацетат-ионов в водной фазе. Это означает, что, несмотря на разные заряды, формы В2+ и ВА+ действуют одинаково на коэффициенты активности в фазе смолы при условии, что они присутствуют только в небольших концентрациях. Поэтому Фронеус рекомендует получать количественные сведения о комилексообразованиии полной фазе на основе измерений, которые относились бы к постоянным и очень небольшим загрузкам смолы. Поэтому ионообменный метод не пригоден для количественного изучения систем, в которых образуются полиядерные формы. Для того чтобы обеспечить независимость констант ![]() от концентрации водородных ионов раствора, следует использовать сильнокислую однофункцнональную смолу, такую, как сульфированный полистирол (например, Дауэкс 50, Цеокарб 225 или Амберлит 120). Дальнейшим недостатком слабокислых смол, содержащих фенольные группы, является их тенденция к восстановлению поглощенных форм (например, иона VО2+ ). Если используются сильнокислые обменники при малой и постоянной загрузке, то коэффициенты активности в фазе смолы и отсюда стехиометрический коэффициент распределения между смолой и постоянной ионной средой будут оступаться постоянными.
от концентрации водородных ионов раствора, следует использовать сильнокислую однофункцнональную смолу, такую, как сульфированный полистирол (например, Дауэкс 50, Цеокарб 225 или Амберлит 120). Дальнейшим недостатком слабокислых смол, содержащих фенольные группы, является их тенденция к восстановлению поглощенных форм (например, иона VО2+ ). Если используются сильнокислые обменники при малой и постоянной загрузке, то коэффициенты активности в фазе смолы и отсюда стехиометрический коэффициент распределения между смолой и постоянной ионной средой будут оступаться постоянными.
Общее предположение, что только положительно заряженные формы сорбируются на катионите, было проверено на системе оксалата магния. Если оно справедливо в любом случае,- то распределение центральной группы между катионитом и раствором определяется выражением
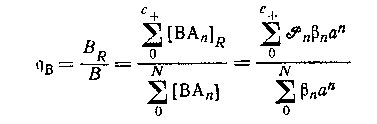
при условии, что коэффициенты активности в обоих фазах соответственно контролируются. Метод ограничивается системами комплексов катионных центральных групп с отрицательно заряженными лигандами.
Катионный обмен не является ни относительно точным, ни относительно удобным методом для определения констант устойчивости большинства систем. Функцию nв(а) невозможно определить с такой же точностью, которую часто получают в потенциометрии, а интерпретация данных включает (с++1) параметров в дополнение к искомым величинам βn.Так как В не может меняться в большой области концентраций, то этот метод ограничивается моноядерными системами. Более того, возникают заметные изменения nв от а, если лигандом является анион. Однако метод пригоден для изучения систем, в которых В следует сохранять очень низким (например, вследствие образования полиядерных форм при макроконцентрациях или из-за большой радиоактивности или недостаточного количества группы В). Наиболее удобно, когда происходит распределение только центральной группы, но для катионного обмена были получены обнадеживающие результаты, которые согласуются с данными других методов в системах с с+>0.
3. анионный обмен
Анионный обмен, так же как и катионный, может быть применен для изучения комплексообразования между положительно заряженной центральной группой и отрицательно заряженным лигандом. Однако его использование осложнено тем, что в добавление к анионным комплексам на смоле также адсорбируются лиганд и анион фонового электролита. Поэтому состав обменника и, следовательно, коэффициенты активности в фазе смолы будут сильно меняться в зависимости от состава водной фазы, если в макроконцентрации присутствует более чем один тин аниона. В таких случаях коэффициент распределения является чрезвычайно сложной функцией от а. Поэтому для изучения анионного обмена нельзя применять фоновый электролит, если лиганд не присутствует в микроконцептрациях. Но часто оказывается, что для образования анионных комплексов необходимы высокие концентрации свободного лиганда. В благоприятных случаях коэффициенты активности в обменнике можно считать постоянными, если используются следовые концентрации группы В и если обменник насыщен лигандом. Однако анионообменный метод имеет тот большой недостаток, что поскольку не может быть использована постоянная ионная среда, то нельзя контролировать коэффициенты активности в водной фазе.
