Исследование свойств продуктов циклизации алициклического 1,5,9-трикетона
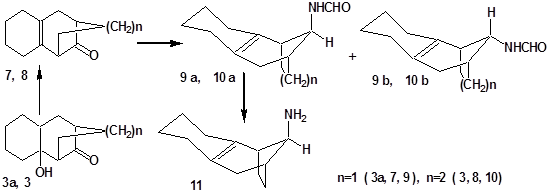
Известны примеры введения в реакцию Лейкарта кетонов каркасной структуры [19-21]. Так, трициклен 7 в результате реакции Лейкарта [19] образует стереоизомерные по мостиковому углеродному атому формиламины 9 а, b с преимущественным содержанием изомера 9 а с аксиальным расположением формиламинного заместителя, который легко переходит в соответствующий амин 11 путем щелочного гидролиза [22]. Гидроаминирование по Лейкарту близкого аналога соединения 7 – трициклена 8, также приводит к смеси стереоизомерных продуктов 10 a, b, однако в этом случае преобладает изомер 10 b с экваториально расположенной формиламинной группой, т.е. стереохимия гидроаминирования карбонильных групп кетонов 7 и 8 противоположна.
Причина этого кроется в том, что в пятичленном цикле соединения 7 не проявляются 1,3-диаксиальные взаимодействия, характерные для шестичленных циклов, и подход гидрид-иона со стороны пятичленного цикла менее затруднен. На приведенной ниже схеме показано, что подход восстановителя в молекуле интермедиата А возможен с обеих сторон двойной связи С=N, тогда как в молекуле интермедиата B он с одной стороны блокирован:

Соответствующий трициклену 8 кетол 3 в условиях реакции Лейкарта дециклизуется и в реакции с формамидом дает пергидро- и октагидроакридины 12 и 13 [20-22]:
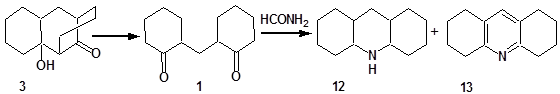
Если в реакцию Лейкарта вводится дикетон или соединение, содержащее наряду с карбонильной группой гидроксил, карбоксил, то реакция обычно не останавливается на стадии образования аминов, а сопровождается циклизацией [24, 25]. Таким примером может служить введение в реакцию гидроаминирования арилалифатического 1,5,9-трикетона 14 [25]. При микроволновом облучении в течение 1 минуты диастереомерной смеси трикетона 14 с формиатом аммония в этиленгликоле образуется диастереомерная смесь третичных аминов 15 а и 15 b с выходом 87 % в соотношении 2:1, разделение которой проводилось колоночной хроматографией.
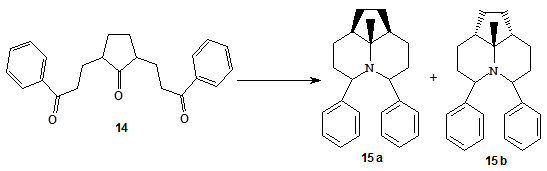
Сам трикетон 14 получается в качестве побочного продукта (7 %) в реакции основания Манниха 16 с циклопентаноном при нагревании до 155 °С (схема 2, путь (а)). Основным продуктом реакции является 1,5-дикетон 17 (n=1). При проведении реакции при микроволновом облучении выход 14 увеличивается до 17 %. А в реакции основания Манниха 16 с циклогексаноном (термические условия, микроволновое облучение) образуется только 1,5-дикетон 18. Образование трикетона в этой реакции не наблюдается.
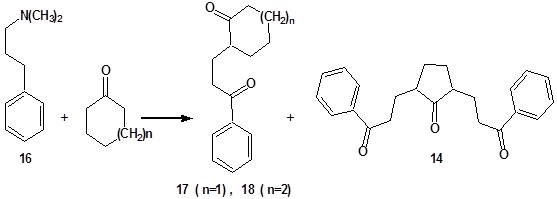
реакция восстановительный конденсация формальдегид
3. Реакция Чичибабина
Традиционным химическим способом установления структуры 1,5-дикетонов является циклизация их в производные пиридина. Циклизация по Чичибабину состоит во взаимодействии 1,5-дикетонов с уксуснокислым аммонием в уксусной кислоте [26]. В эту реакцию вступают арилалифатические, алициклические, симметричные и нессиметричные дикетоны. В случае бициклических 1,5-дикетонов в реакции образуются октагидроакридины. Продукты их внутримолекулярной циклокетолизации - b-кетолы [24, 26] образуют те же азотистые основания:
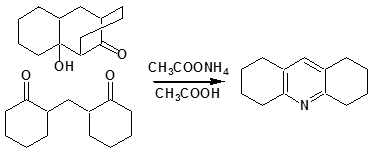
Тиличенко и сотрудники [27], изучая реакцию метиленбисциклогексанона с уксуснокислым аммонием, предположили первоначальное образование декагидроакридина, который диспропорционируется, образуя октагидроакридин и додекагидроакридин:
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Направление проведенных реакций представлено на схеме (4):
Схема 4

1. Исследование реакции конденсации циклогексанона с формальдегидом в разных условиях
Прежде, чем изучать химические свойства соединения 5, мы сначала попытались установить лучший способ его получения, сравнив известные методики синтеза. Соединение 5 везде получалось в качестве побочного продукта при получении 1,5-дикетона конденсацией циклогексанона с формальдегидом.
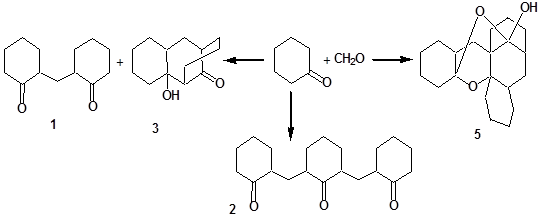
К настоящему времени в литературе описано несколько таких методик. По методике Тиличенко [1] смесь 1 моль (100 мл) циклогексанона и такой же объем (100 мл) 0,2н спиртового раствора едкого натра нагревали до 55 °С и добавляли 0,5 моль формальдегида. Смесь разогревалась и закипала, через несколько минут кипение прекращалось. Смесь оставляли стоять, а на следующий день выпавшие кристаллы отфильтровывали. Выход 11,2 г (14,1%). Из маточного раствора при стоянии выделилось еще 3,7 г. Общий выход 14,9 г (18,8%) соединения 5.
По методу Плешека [7] к смеси 1 моль циклогексанона, 0,5 моль 33 % формальдегида и 100 мл метанола добавлялся 4н спиртовой раствор едкого кали (100 мл). Смесь нагревалась до кипения и разделялась на 2 слоя. Маслянистый слой отделяли, разбавляли 200 мл метанола. Выделяли 20 г (22%) не идентифицированного соединения С19Н28О3 с Т.пл. 193 °С.
По методу Колонжа [2, 28] конденсация циклогексанона с параформом в соотношении 3:1 проводилась в безводной среде в присутствии метилата калия.
Мы повторили все эти методики, исследуя продукты реакции с помощью ГЖХ-МС. Соединение 5 выпадает в осадок сразу после проведения реакции. Осадки, выпадающие в реакционной смеси, оставленной без нейтрализации на второй и третий день, оказались не соединением 5 (как считается в методике Тиличенко), а кетолом 3 в виде двух его стереоизомерных форм в соотношении 1:1. Таким образом, выходы целевого продукта, указанные в статье Тиличенко [1], завышались.
Соединение 5 с наибольшим выходом (13 %) было получено нами по методу Колонжа. И в дальнейшем получение этого соединения проводилось именно этим методом. Во всех описанных синтезах при смешивании реагентов мы наблюдали разогрев реакционной смеси до кипения. По окончании реакции смесь нейтрализовали соляной или уксусной кислотой, а выпавший осадок по данным ГЖХ-МС (рис. 1) и ИК-спектра (рис. 2) представлял собой продукт 5. При проведении синтезов с меньшими количествами веществ (0,06 моль циклогексанона) наблюдалось слабое разогревание реакционной смеси, и для ее кипения требовался дополнительный нагрев, а выход продукта уменьшался почти в 2 раза.
В масс-спектре продукта 5 прослеживается ретромихаэлевский распад. Кроме пиков молекулярного иона [М]+=318 и [М-Н2О]+=300, присутствуют фрагменты [М-С6Н10О]+ с массой 220 единиц (отщепление циклогексанового кольца), [С6Н8О-СН2]+ и [С6Н10О]+ с массами 110 и 98 единиц соответственно.

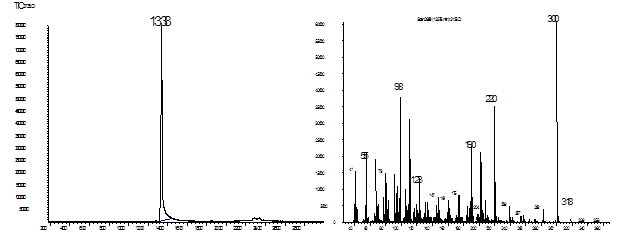 Рис. 1 Хроматограмма и масс-спектр
Рис. 1 Хроматограмма и масс-спектр
