Исследование фазовых эффектов в бинарных азеотропных смесях
Коннода – это отрезок, соединяющий функции состояния системы. К этим функциям относятся экстенсивные величины: объем, энтропия и составы фаз двухфазной системы. Реконнода – отрезок, ориентированный противоположно конноде.
Запишем нулевой потенциал Гиббса для двухфазной системы жидкость-пар:
Sж dT –Vж dР+ x1 dμ1 + x2 dμ2+…+xn dμn=0 1.13
Sп dT –Vп dР+ y1 dμ1 + y2 dμ2+…+yn dμn=0
Условие равновесия фаз определяется следующими равенствами:
Рж=Рп
Тж=Тп
μ1ж= μ1п 1.14
μ2ж= μ2п
………
μnж= μnп
В связи с этим верхние индексы в уравнениях нулевого потенциала опущены.
Рассмотрим знаки при элементах нулевого потенциала. Фундаментальное энергетическое уравнение имеет вид:
dU = Т dS - P dV + μ1 dx1+ μ2 dx2 +…+ μn dxn 1.15
Отметим, что в общем случае направление конноды определяет направление ноды, а направление реконоды определяет направление реноды.
Если же за основу мы возьмем уравнение 1.13, то очевидно получим уравнение конноды:
<-(Sп- Sж) dT +(Vп-Vж) dР - (y1- x1) dμ1 - (y2- x2) dμ2-…-(yn- xn) dμn> 1.16
и уравнение реконноды:
<- (Sж- Sп) dT +(Vж-Vп) dР - (x1- y1) dμ1 - (x2- y2) dμ2-…-(xn- yn) dμn> 1.17
Аналогично выглядят векторы ноды в этом случае (когда используется уравнение 1.13)
ноды < y1- x1, y2- x2,…yn- xn> 1.18
реноды < x1- y1, x2- y2,… xn- yn>
Когда используется уравнение 1.10
ноды < x1- y1, x2- y2,… xn- yn> 1.19
реноды < y1- x1, y2- x2,…yn- xn>
В рассмотренных случаях, т.е., когда за основу берется уравнение 1.13 и уравнение 1.10, ориентации векторов получаются противоположные.
1.6. Изменение концентрации фаз при фазовом обмене при постоянной температуре и давлении.
Рассмотрим изменение концентрации компонента i в жидкой фазе в зависимости от того, приходит dm молей паровой фазы в жидкую или уходит dm молей паровой фазы из жидкой.
Здесь существует два способа вывода уравнений.
1. Бесконечно малое количество компонента i может быть выражено двояко:
с одной стороны [16]
dmi = d(m xi) 1.20
с другой стороны
dmi= yidm 1.21
приравняв эти выражения, получаем:
d(m xi) = yidm 1.22
т.е. m dxi+ xi dm = yidm 1.23
m dxi = (yi -xi) dm
или ![]() , где dt= dln m 1.24
, где dt= dln m 1.24
Допустим i=1 Ki>1, тогда
yi >xi dt>0, dxi>0
dt<0, dxi<0
если i=2 Ki<1,
yi <xi dt>0, dxi<0
dt<0, dxi>0
2. Второй способ изложен в [17]
Для систем испарения:
m xi =(m-dm)( xi -dxi) + yi dm 1.25
m xi = m xi -m dxi- xi dm + dm dxi + yi dm
после отбрасывания бесконечно малых второго порядка имеем:
m dxi=( yi -xi)dm
![]() ; dt= dln m<0
; dt= dln m<0
Если же идет конденсация dm молей пара в жидкость, имеем:
yi dm + m xi = (m+dm)( xi +dxi) 1.26
или
yi dm + m xi = m xi + m dxi +xi dm + dm dxi
dm (yi - xi) = m dxi 1.27
![]() ; dt= dln m>0 1.28
; dt= dln m>0 1.28
Обоими методами мы получили один и тот же результат, а именно: если рассматривается изменение состояния жидкой фазы, используется нода, а не ренода.
Теперь рассмотрим изменение концентрации компонента i в паровой фазе, в зависимости от того, приходит ли dm молей состава xi из паровой фазы. Здесь также существует два метода вывода уравнений:
1. Для систем испарения:
xi dm= d(m yi) 1.29
xi dm= yi dm + m dyi 1.30
dm (xi- yi) = m dyi 1.31
или ![]() 1.32
1.32
2. Для систем конденсации:
m yi =(m-dm)( yi -dyi) + xi dm 1.33
m yi = m yi -m dyi- yi dm + dm dyi + xi dm
после отбрасывания бесконечно малых второго порядка имеем
m dyi=(xi -yi)dm 1.34
или ![]() , dt= dln m<0 1.35
, dt= dln m<0 1.35
Для систем смешения (с dt>0)
m yi + xi dm = (m+dm)( yi +dyi) 1.36
m yi + xi dm = m yi + m dyi-+ yi dm + dm dyi 1.37
dm (xi- yi ) = m dyi 1.38
![]() , dt= dln m>0 1.39
, dt= dln m>0 1.39
Второй метод более громоздок. Каждый вывод предусматривает dt>0 или dt<0.
Первый метод более универсален и лаконичен. Основной вывод заключается в том, что при исследовании изменения концентраций за счет добавления или удаления из данной фазы dm молей состава другой фазы, для жидкой фазы используется нода, а для паровой фазы - ренода. Это правило действует в случае балансовых соотношений.
1.7. Общие фазовые эффекты.
Общие фазовые эффекты отражают изменение химических потенциалов компонентов при изменении их концентрации за счет фазового обмена [1]. Рассмотрим m молей жидкой фазы и допустим, что пришло (или ушло) в нее dm молей состава паровой фазы. Как и прежде dt= dln m. Тогда при постоянном давлении и температуре имеет место:
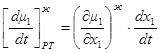 1.40
1.40
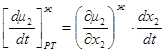 1.41
1.41
но ![]() и
и ![]()
используя эти соотношения, из 1.40 и 1.41 получим:
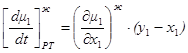 1.42
1.42
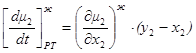 1.43
1.43
Обозначив
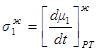 1.44
1.44
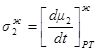 1.45
1.45
получим
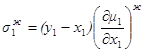 1.46
1.46
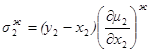 1.47
1.47
Таким образом, при
y1>x1 , dt>0 dx1>0 ![]()
![]()
y2<x2 , dt>0 dx2<0 ![]()
Обычно говорят, что если фазовый эффект ![]() положителен, то компонент i «высаливается» из жидкой фазы, а если он отрицателен, то компонент i «всаливается» в жидкую фазу. Это означает, что при организации открытого равновесного испарения количество компонента 1 будет уменьшаться в жидкой фазе, а количество компонента 2 увеличиваться. Последнее понятно, так как уходящий пар будет обогащен легколетучим (первым) компонентом и обеднен тяжелолетучим (вторым) компонентом. Обратим внимание на тот факт, что в случае dt<0 (испарения при постоянных Р и Т) компоненты 1 и 2 меняются местами.
положителен, то компонент i «высаливается» из жидкой фазы, а если он отрицателен, то компонент i «всаливается» в жидкую фазу. Это означает, что при организации открытого равновесного испарения количество компонента 1 будет уменьшаться в жидкой фазе, а количество компонента 2 увеличиваться. Последнее понятно, так как уходящий пар будет обогащен легколетучим (первым) компонентом и обеднен тяжелолетучим (вторым) компонентом. Обратим внимание на тот факт, что в случае dt<0 (испарения при постоянных Р и Т) компоненты 1 и 2 меняются местами.
Перейдем к фазовым эффектам в паровой фазе.
Здесь
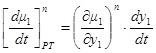 1.48
1.48
