Каталитическая конверсия метана водяным паром
1.1. По закону Гесса находим тепловой эффект химической реакции при нормальных условиях:
DН![]() =(SniDН
=(SniDН![]() )
)![]() - (SniDН
- (SniDН![]() )
)![]()
DН![]() = 0×3 - 110,53 + 241,81 + 74,85 = 206,13 кДж/моль
= 0×3 - 110,53 + 241,81 + 74,85 = 206,13 кДж/моль
1.2. Найдем энтропию реакции:
DS![]() = (SniDS
= (SniDS![]() )
)![]() - (SniDS
- (SniDS![]() )
)![]()
DS![]() =3×130,52 +197,55 -188,72 -186,27= 214,12 Дж/моль×К
=3×130,52 +197,55 -188,72 -186,27= 214,12 Дж/моль×К
1.3. Найдем изменение энергии Гиббса в ходе реакции при нормальных условиях:
DG![]() = (SniDG
= (SniDG![]() )
)![]() -(SniDG
-(SniDG![]() )
)![]()
DG![]() = 3×0-137,15+288,61+50,85=142,31 кДж/моль
= 3×0-137,15+288,61+50,85=142,31 кДж/моль
2. Найдем функцию зависимости теплоемкости от температуры С![]() = f(Т)
= f(Т)
|
СН |
Н |
СО |
Н | |
|
a |
14,32 |
30 |
28,41 |
27,28 |
|
b |
74,66×10 |
10,71×10 |
4,1×10 |
3,26×10 |
|
с’ |
0,33×10 |
-0,46×10 |
0,5×10 | |
|
с |
-17,43×10 |
Ср(СН4) = 14,32 + 74,66×10![]() Т - 17,43×10
Т - 17,43×10![]() Т
Т![]()
Ср(Н2О) = 30 + 10,71×10-3Т + 0,33×105Т-2
Ср(СО) = 28,41+ 4,1×10-3×Т - 0,46×105Т-2
Ср(Н2) = 27,28 + 3,26×10-3Т + 0,5×105Т-2
DСр = Dа + DbT + Dс’Т2+DcТ-2
DСр = (3×27,28+28,41-30-14,32) + (3×3,26+4,1-10,71-74,66)×10-3Т +
+ (3×0,5-0,46-0,33)×105Т-2 - 17,43×10-6Т2
DСр = 65,93 - 71,49×10-3Т + 0,71×105Т-2 - 17,43×10-6Т2 Дж/моль×К
2.1. Для азота зависимость теплоемкости от температуры выглядит следующим образом:
Ср(N2) = 27,88 + 4,27×10-3Т
3.1. Найдем изменение энтропии в ходе реакции при нагревании от t1=25![]() C до t2=900
C до t2=900![]() C:
C:
DS=![]()
![]() dТ =
dТ =
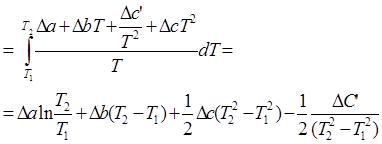
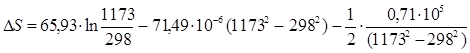
DS=16.54 Дж/моль×К
3.2. Найдем изменение энтальпии в ходе реакции при нагревании от t1=25°C до t2=900°C:
![]()
DH= 65,93 (1173-298) - ![]() ×71,49×10-3(11732-2982) -
×71,49×10-3(11732-2982) - ![]() -
- ![]()
DН= - 2375 Дж/моль
3.3. Рассчитаем энергию Гиббса на выходе t2=900°С:
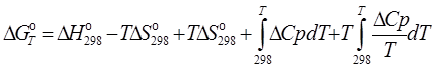
![]()
4. Найдем константу равновесия:
DG°=-RTlnKp
Kp = exp(-DG°/RT)
Kp=exp(-(-62058,71/8,31×1173))=582,04
4.1. Рассчитаем равновесную степень превращения метана. При температуре от 827°С и составе исходной смеси СН4 : Н2О = 1 : 2 необходимо проводить процесс при абсолютном давлении 10 атм.
СН4 + Н2О ® СО + 3Н2
т.к. водяной пар в избытке, то РН2О = 2РСН4
Робщ = РСН4 + 2РСН4= 3РСН4
РСН4 = Робщ/3 = 10/3 атм.
При равновесии:
![]()
![]()
![]()
![]()
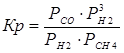
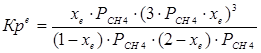
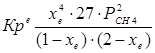

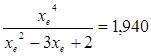
![]()
