Квантово-химические правила отбора элементарных стадий
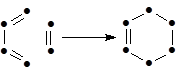 (35)
(35)
G1 G2
Такое уравнение называют символьным или базовой реакцией.
Далее можно удалить связи, остающиеся неизменными, в результате чего получается уравнение (36), отражающее тип реакции:
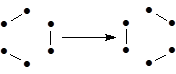 (36)
(36)
G3 G4
Наложение графов G3 и G4 дает граф G5,

G5
называемый идентификатором топологии (ИТ) или топологией категории реакции. ИТ отражает топологию перераспределения связей и упрощенно представляет топологию переходного состояния (в данном случае циклическую). Если предполагают одновременный разрыв и (или) образование кратных связей, тогда в графах G3, G4 и G5 возникают кратные ребра, образующие дополнительные циклы в ИТ. Проведенный анализ различных баз стадий и органических реакций показал, что среди стадий, которые можно достаточно обоснованно отнести к ЭС, практически не встречается стадий со смешанными (линейно-циклическими) или более сложными (полициклическими) ИТ.
Таким образом, анализ топологической структуры (ИТ) можно использовать для отбора элементарных стадий, т.е. реакций, которые с топологической точки зрения имеют высокий шанс быть элементарными:
Стадии, переходные состояния которых не имеют простой топологии (циклической или линейной), не рассматриваются как элементарные.
Если в ходе реакции одновременно (синхронно) разрываются (или образуются) кратные связи, будем изображать их двумя (или тремя) дугами при изображении типа реакции:
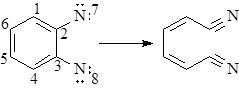 (37)
(37)
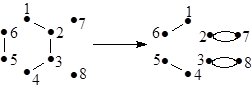 ИТ:
ИТ:  (38)
(38)
В рамках изложенных представлений реакцию (37) не следует рассматривать как согласованный элементарный акт.
К топологическим правилам можно отнести также эвристическое правило, касающееся числа рвущихся и образующихся связей в ходе элементарной реакции. Анализ элементарных стадий с этой точки зрения показал, что в подавляющем большинстве случаев разница |Dq| числа рвущихся и образующихся связей не превышает 1
|Dq| £ 1,
независимо от знака DH0 элементарной стадии. Согласно этому правилу реакция (37) также не является элементарной (|Dq| = 2).
Заключение
Сформулируем набор правил для отбора термодинамически разрешенных термических ЭС. Элементарными реакциями, в первом приближении, можно считать реакции, для которых:
§ молекулярность прямой и обратной реакций меньше или равна 2 (m £ 2);
§ число рвущихся связей не отличается от числа образующихся более, чем на 1 (правило компенсации связей |Dq| £ 1);
§ занятые граничные орбитали реагентов коррелируют по симметрии с занятыми граничными орбиталями продуктов (граничные орбитали донора и акцептора имеют одинаковую симметрию);
§ топология перераспределения связей (топологическая структура переходного состояния) является линейной или циклической.
Принцип наименьшего движения можно рассматривать как дополнительное правило самого общего характера.
Вопросы для самоконтроля
1) Назвать основные законы, правила и принципы в теории элементарных стадий.
2) Перечислить правила отбора ЭС.
3) Рассчитать число электронов в валентной оболочке металла в соединениях: K2ReH9, Mn2(CO)10, (h3–C3H5)NiCl(PR3)2, Na2PtCl6, OsO4, NºOsCl3, (h6–C6H6)2Cr, HNiL4+, K4Pd(CN)4.
4) Определить, может ли реакция
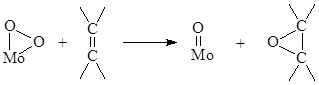
быть элементарной стадией.
5) Определить, какая из двух реакций пойдет быстрее и во сколько раз (298К):
![]() ∆H10 = – 48.1 кДж/моль
∆H10 = – 48.1 кДж/моль
![]() ∆H20 = –36.3 кДж/моль
∆H20 = –36.3 кДж/моль
Литература для углубленного изучения
1. Гаммет Л., Основы физической органической химии, М., Мир, 1972.
2. Денисов Е.Т., Саркисов О.М., Лихтенштейн Г.И., Химическая кинетика, М., Химия, 2000, 566 с.
3. Хоффман Р., Механизмы химических реакций, М., Химия, 1979.
4. Клопман Г., Общая теория возмущений и ее применение к химической реакционной способности, в кн.: “Реакционная способность и пути реакций”, под. ред. Клопмана Г., М., Мир, 1977, с. 64.
5. Вудворд Р., Хоффман Р., Сохранение орбитальной симметрии, М., Мир, 1971.
