Кинетика химических и электрохимических процессов
Ответ: I = 0,011.
8. Удельная электрическая проводимость с = 5%-го раствора нитрата магния при 18 оС равна 4,38 Ом-1.м-1, а его плотность – 1,038 г.см-3. Рассчитайте эквивалентную электрическую проводимость раствора λ и кажущуюся степень диссоциации соли в растворе. Подвижности ионов Mg2+ и NO3- при 18 оС равны 44,6 и 62,6 Ом-1.см2.моль-1.
Решение. М = с.r/М![]() = 0,05.1,038/148.1000 = = 0,70 моль.л-1; l = c/(с.1000) = 4,38/(0,70.1000) = = 6,25.10-3; l∞= 44,6 + 62,6 =107,2 Ом-1.см2.моль-1; a = l/l∞ = 62,5/107,2 = 0,583.
= 0,05.1,038/148.1000 = = 0,70 моль.л-1; l = c/(с.1000) = 4,38/(0,70.1000) = = 6,25.10-3; l∞= 44,6 + 62,6 =107,2 Ом-1.см2.моль-1; a = l/l∞ = 62,5/107,2 = 0,583.
Ответ: l = 62,510-3 Ом-1.м2.моль-1; a = 0,583.
1.3 Задачи для самостоятельного решения
1. Константа диссоциации масляной кислоты С3Н7СООН равна 1,5.10-5. Вычислите степень ее диссоциации в 0,005 М растворе.
2. Чему равна концентрация ионов водорода в водном раст-воре муравьиной кислоты, если α = 0,03?
3. Вычислите ионную силу и активность ионов в растворе, содержащем 0,01 моль/л Ca(NO3)2 и 0,01 моль/л CaCl2.
4. Рассчитайте активность электролита а и среднюю ионную активность а± в растворе CaCl2 при 25 оC, если средний ионный коэффициент активности γ± = 0,518, а молярная концентрация m = 0,1.
5. Для реакции диссоциации муравьиной кислоты: НСООН ↔ Н+ + НСОО- дана зависимость константы от температуры: lgКД = -1342,85/Т + 5,2743 – 0,0152.T. Вычислите теплоту диссоциации муравьиной кислоты в разбавленном вод-ном растворе.
6. Определите температуру, при которой диссоциация му-равьиной кислоты в водном растворе максимальна. Уравнение зависимости константы диссоциации НСООН от температуры приведено в предыдущей задаче.
7. Рассчитайте удельную электрическую проводимость абсолютно чистой воды при 25 оС. Ионное произведение воды при этой температуре равно 1.10-14.
8. Эквивалентные электрические проводимости бесконечно разбавленных растворов KCl, KNO3, и AgNO3 при 25 оС равны соответственно 149,9, 145,0 и 133,4 Ом-1.см2.моль-1. Какова эквивалентная электрическая проводимость бесконечно разбавленного раствора AgCl при этой температуре?
9. Удельная электрическая проводимость 4 % -го водного раствора Н2SO4 при 18 оС равна 0,168 Ом-1.см-1, плотность раствора равна 1,026 г/см3. Рассчитайте эквивалентную электри-ческую проводимость этого раствора.
10. Для 0,01 молярного раствора KCl удельное сопротивление равно 709,22 Ом.см. Вычислите удельную и эквивалентную электрические проводимости.
11. Какую долю общего тока переносит ион Li+ в водном растворе LiBr при 25 оС?
12. Эквивалентная электрическая проводимость раствора уксусной кислоты молярной концентрации 1,59.10-4 моль.л-1 при 25 оС равна 12,77 Ом-1.см2.моль-1. Рассчитайте константу диссо-циации кислоты и рН раствора.
13. Для бесконечно разбавленного раствора NH4Cl при 298,2 К число переноса катиона t+ = 0,491. Вычислите электро-литическую подвижность и абсолютную скорость движения аниона Cl-; λ∞(NH4Cl) = 0,015 Ом-1.моль-1.м2.
14. При электролизе раствора AgNO3 на катоде выделилось 0,5831 г серебра, убыль AgNO3 в анодном пространстве соста-вила 2,85.10-3 моль. Определите числа переноса t+ и t- для AgNO3.
15. При электролизе раствора AgNO3 c серебряными электродами увеличение количества соли в анодном про-странстве составило 0,0625 г. Чему равна убыль соли, г, в катодном пространстве?
2. ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
2.1 Необходимые исходные сведения и основные уравнения
ЭДС гальванического элемента Е равна разности условных электродных потенциалов его полуэлементов φ1 и φ2. Если значением диффузионного потенциала можно пренебречь то
Е = φ2 - φ1(2.1)
(индекс 2 относится к более положительному электродному потенциалу). Электрохимические реакции, протекающие на электродах, и сами электроды разделяют на следующие типы:
1. Электроды 1-го рода, обратимые по катиону: Меn+ + ne = = Ме0, где Меn+ и Ме0 ― окисленная и восстановленная формы вещества; nе - количество электронов. Потенциал электрода 1-го рода рассчитывается по уравнению Нернста:
φ = φ0![]() (aOx/aRed),(2.2)
(aOx/aRed),(2.2)
где φ - потенциал электрода, В; φ0 - стандартный потенциал электрода, В; n - число электронов, участвующих в элемен-тарной реакции; F - число Фарадея; aRed и aOx - активности вос-становленной и окисленной форм вещества, вступающего в реакцию. Множитель ![]() при Т = 298 К и значении R, равном 8,31 Дж/(моль.К), равен 0,059. К электродам 1-го рода относятся:
при Т = 298 К и значении R, равном 8,31 Дж/(моль.К), равен 0,059. К электродам 1-го рода относятся:
а) серебряный электрод:
Ag+│Ag; Ag+ + e = Ag0; n =1;aOx = aAg+; aRed = aAg =1,
φ = φ0Ag+ ![]() lgaAg+; (2.3)
lgaAg+; (2.3)
б) амальгамный электрод:
Cd2+ │[Cd] (Hg)Cd2+ + 2e = [Cd]ам; n = 2; aOx = aCd+
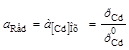 ; φ = φ0AСd2+
; φ = φ0AСd2+  ,(2.4)
,(2.4)
где φ![]() - потенциал амальгамного электрода при активности кадмия в амальгаме, а[Cd] = 1;
- потенциал амальгамного электрода при активности кадмия в амальгаме, а[Cd] = 1;
в) газовый электрод:
H+ │Pt, H2; H+ + e =½ H2; n = 1; aOx = aH++; aRed = ![]() =
= ![]() ;
;
φ = φ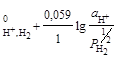 .(2.5)
.(2.5)
2. Электроды 2-го рода, обратимые по аниону, представляют собой металл, покрытый труднорастворимой солью этого метал-ла, который находится в равновесии с раствором, содержащим соответствующий анион: AgCl + e = Ag + Cl-; n=1; aOx = aAgCl = 1; aRed = aCl-;
φ = φ![]() ; (2.6)
; (2.6)
φ02 = φ![]() ,(2.7)
,(2.7)
где j ![]() ― стандартный потенциал серебряного электрода, обратимого по катиону; ПРAgCl ― произведение растворимости хлорида серебра. К электродам 2-го рода относятся:
― стандартный потенциал серебряного электрода, обратимого по катиону; ПРAgCl ― произведение растворимости хлорида серебра. К электродам 2-го рода относятся:
а) газовый электрод:
½ Cl2 + e = Cl-; n = 1; aOx = ![]() ; aRed =
; aRed = ![]() ;
;
φ = φ![]() . (2.8)
. (2.8)
б) каломельный электрод Cl-│Hg2Cl2, на котором идет электродная реакция HgCl2 + 2e = Hg+ + 2Cl- ;
φ![]() φ
φ![]() .
.
в) хлорсеребряный электрод Cl-│AgCl, Ag, на котором идет электродная реакция AgCl + e = Ag+ + Cl-;
φ![]() φ
φ![]() .
.
