Кинетика химических и электрохимических процессов
Окислительно-восстановительные электроды (редокси – электроды) представляют собой инертный металл, опущенный в раствор, содержащий окисленную и восстановленную формы. Уравнение Нернста для данных электродов имеет вид:
φ Red = φ![]() , (2.9)
, (2.9)
где аОх(аО) ― активность окисленного иона; aRed(aВ) - активность восстановленного иона. Они делятся:
а) на простые: Fe3+ + e = Fe2+; n = 1; aRed = ![]() ; aOx =
; aOx = ![]() ;
;
φ = φ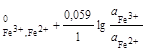 ; (2.10)
; (2.10)
![]() ; n = 1;
; n = 1; ![]() ;
; ![]() ;
;
φ = φ![]() ; (2.11)
; (2.11)
б) на сложные:
![]() ;
;
φ = φ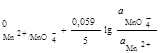 . (2.12)
. (2.12)
Хингидронный электрод: C6H4O2 (хинон) + 2H+ + 2e = = C6H4(OH)2 (гидрохинон);
n = 2, aRed = aгх = 1; аОх = ах = 1;
φ = φ![]() + φ
+ φ![]() . (2.13)
. (2.13)
Связь константы равновесия химической реакции и стандартных электродных потенциалов выражается соотноше-нием
![]() (φ02 – φ01).n/0,0592 (Т = 298 К). (2.14)
(φ02 – φ01).n/0,0592 (Т = 298 К). (2.14)
Для концентрационных цепей уравнение Нернста (при отсутствии диффузионного потенциала) для электродов типа
Cu | Cu2+ ║ Cu2+ | Cu ; Ag, AgCl | HCl ║ HCl | Ag, AgCl
a1 a2 (a2 > a1) a1 a2 (a2 > a1)
имеет вид
![]() , (2.15)
, (2.15)
где а1 и а2 ─ активности ионов Cu2+ и Cl- соответственно.
Для электродов 2-го рода типа: Pt, H2 (P1) | HCl | Pt, H2 (P2), уравнение (2.15) преобразуется в уравнение
![]() (Р1/Р2), (2.16)
(Р1/Р2), (2.16)
где P1 и P2 - давления водорода, P1 > P2.
Для амальгамного элемента: Hg [Cd] (a1) | Cd2+ | Hg [Cd] (a2), (a2 > a1), уравнение Нернста имеет вид
![]() (а1/а2), (2.17)
(а1/а2), (2.17)
где a1 и a2 ─ активности металлического кадмия в амальгаме. Для элемента типа: Cd(ж) (a1 = 1) | Cd в расплаве солей | Cd в расплаве Cd – Sn (a2) уравнение (2.17) принимает вид
![]() , (2.18)
, (2.18)
где a2 ─ активность кадмия в расплаве Cd – Sn.
Расчет ЭДС концентрационной цепи (например, серебряной, Ag | AgNO3 (а1) ║ AgNO3 (а2) | Ag,) производится по формуле
Е = 2. 0,059. l∞,![]() . lg(а1/а2) /(l∞,
. lg(а1/а2) /(l∞,![]() +l∞,
+l∞,![]() ) (2.19)
) (2.19)
где λ∞,Ag+ и λ∞,![]() - подвижности аниона и катиона.
- подвижности аниона и катиона.
Термодинамические функции ΔG, ΔS, ΔH для электрохимических реакций рассчитывают по уравнениям:
ΔG = - nEF, (2.20)
![]() , (2.21)
, (2.21)
![]() , (2.22)
, (2.22)
![]() , (2.23)
, (2.23)
![]() , (2.24)
, (2.24)
где n – число электронов, участвующих в реакции; F – число Фарадея, Кл; E – ЭДС, В.
2.2 Задачи с решениями
электролит проводимость потенциал кинетика
1. Гальванический элемент состоит из металлического цинка, погруженного в 0,1 М раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Вычислите ЭДС элемента.
Решение. Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы. Для этого из табл. [8], берем значения стандартных электродных потенциалов систем Zn2+|Zn (-0,76 В) и Pb2+|Pb (-0,13 В), а затем рассчитываем значение φ по уравнению Нернста: φZn/Zn2+ = -0,76+(0,059.lg0,1)/2 = =-0,79 В, φPb/Pb2+=-0,13+(0,059.lg0,02)/2=-0,18 В. Находим ЭДС элемента: Е = φ Pb/Pb2+ – φ Zn/Zn 2+ = -0,18+0,79 = 0,61.
Ответ:0,61 В.
2. Вычислите потенциал серебряного электрода в насыщенном растворе AgBr (ПР = 6.10-13), содержащем, кроме того, 0,1 моль/л бромида калия.
Решение. Запишем уравнение Нернста для системы Ag+|Ag: φ = φ0 + 0,059.lg[Ag+]. Значение φ0 для этой системы составляет 0,8 В (табл. [8]). Поскольку бромид калия полностью диссоциирован, то [Br-]=0,1 моль/л. Отсюда находим концентрацию ионов серебра: [Ag+] = ПРAgBr /[Br-] = 6.10-13/0,1 = = 6.10-12 моль/л. Теперь подставляем значения φ0 и [Ag+] в уравнение электродного потенциала: φ = 0,8 + 0,059.lg(6∙10-12) = = 0,14.
Ответ: 0,14 В.
3. Вычислите активность ионов Н+ в растворе, в котором потенциал водородного электрода равен 82 мВ.
Решение. Из уравнения φ = -0,059рН находим: рН = = 0,082/0,059 = 1,39. Следовательно, аН+ = 0,041.
Ответ: аН+ = 0,041 моль/л.
4. Рассчитайте стандартный электродный потенциал пары Cu2+|Cu+ по следующим данным: φ0Cu2+|Cu = 0,337 В, φ0Cu+|Cu = = 0,521 В.
Решение. Для реакции Cu2+ + 2е = Cu, ΔG0 = -nFЕ0 = = −2.96485.0,337 = −65031 Дж.моль-1. Для реакции Cu+ + е = Cu, ΔG0 = −96485.0,521 = −50269 Дж.моль-1. Вычитая из первой реакции вторую, получим Cu2+ + е = Cu+ и, следовательно, ΔG0 = = −14762 Дж.моль-1, откуда Е0 = 0,153.
Ответ: Е0 = 0,153 В.
5. ΔН реакции Pb + Hg2Cl2 = PbCl2 + 2Hg, протекающей в гальваническом элементе, равно −94,2 кДж/моль при 298,2 К. ЭДС этого элемента возрастает на 1,45.10-4 В при повышении температуры на 1 К. Рассчитайте ЭДС элемента и ΔS при 298,2 К.
Решение. ![]() = 2,96485.1,45.10-4 = = 28,0. ΔG = ΔН – ТΔS = nFE, откуда E = − (ΔН - ТΔS)/nF = = 0,5314.
= 2,96485.1,45.10-4 = = 28,0. ΔG = ΔН – ТΔS = nFE, откуда E = − (ΔН - ТΔS)/nF = = 0,5314.
Ответ: ΔS = 28,0 Дж/(моль.К); E = 0,5314 В.
6. Рассчитайте константу равновесия реакции Cd2+ + Zn = = Zn2+ + Cd, если φ0Cd2+/Cd = -403 В; φ0Zn2+/Zn = -0,763 В.
Р е ш е н и е. Константу равновесия вычисляем по уравнению: ![]() (φ02 – φ01).n/0,0592. После подстановки данных получим
(φ02 – φ01).n/0,0592. После подстановки данных получим ![]() = 12,16. Откуда К = 1,45.1012.
= 12,16. Откуда К = 1,45.1012.
Ответ: К = 1,45.1012.
2.3 Задачи для самостоятельного решения
