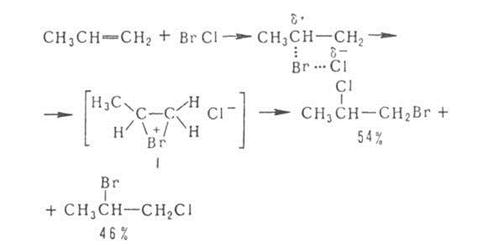
Методы органического синтеза
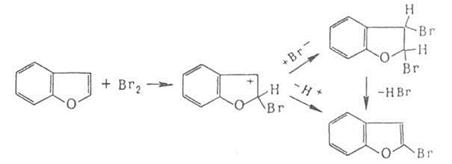
Присоединение галогенов по кратной связи происходит по электрофильному или радикальному механизму. Его можно осуществлять действием галогсноводородов, межгалогенных соединений или гипогалогенитов. В случае электрофильного присоединения может нарушаться правило Марковникова, что обусловлено образованием промежуточного мостикового катиона, например:
Сульфирование (сульфонирование).
Введение сульфо – группы SO2OH в молекулу орг. соединения; в широком смысле сульфирование – введение группы SO2X (X = ОН, ONa, OAlk, OAr, Hal, NAlk2 и т.п.). О введении группы SO3H с образованием связей О–S (О – сульфирование, сульфатирование, сульфоэтерификация).
Процесс, обратный сульфированию (удаление группы SO2X из молекулы орг. соединения), называется десульфированием (десульфонированием). Сульфирование осуществляют прямым путем с использованием сульфирующих агентов либо косвенным путем, например введением сульфогруппы в составе сульфоалкильных фрагментов (СН2)nSО2Х. Сульфирующие агенты: H2SO4, SO3 и его комплексы с орг. соединениями (эфирами, третичными аминами и фосфинами, амидами карбоновых кислот, триалкилфосфатами и др.), олеум, SOCl2, галогенсульфонрвые и сульфаминовые к-ты, диалкилсульфаты, ацилсульфаты.
Сульфирование ароматических углеводородов протекает по механизму электрофильного замещения:
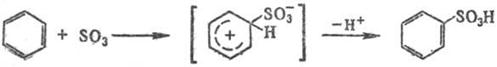
Реакцию осуществляют как в паровой, так и в жидкой фазе (р-рители: SO2, СС14, хладоны и т.п.). При сульфировании серной к-той для смещения равновесия вправо применяют избыток к-ты или связывают воду добавлением олеума, азеотропной отгонкой и т.п.
Соединение с электронодонорными заместителями более реакционноспособны и сульфируются преимущественно в орто- и пара-положения; соединения с электроноакцепторными заместителями- в мета-положение. В большинстве случаев при сульфировании замещенных бензолов образуются смеси изомеров, соотношение к-рых зависит от природы заместителя, сульфирующего реагента и условий р-ций (концентрации реагентов, т-ры, р-рителя, наличия катализаторов и т.д.). Путем подбора оптимальных условий возможно селективное сульфирование. Так, сульфирование толуола серной к-той при 20 °С приводит к равным кол-вам о- и n‑толуолсульфокислот, а при, использовании SO3 в тех же условиях – исключительно к n‑изомеру; при сульфировании фенола на холоду преимущественно образуется о-фгнолсульфокислота, тогда как при 100 °С-n‑фенолсульфокислота. Как правило, подобные различия обусловлены превращением одних изомеров в другие, термодинамически более стабильные, благодаря изомеризации или обратимости сульфирования. Например, нафталин при температурах ниже 100 °С первоначально образует a‑наф-талинсульфокислоту, к-рая во времени превращается в b‑изомер в результате последовательного десульфирования – ресульфирования. Сульфирование при 160 °С приводит исключительно к b‑нафталинсульфокислоте.
Для сульфирования гетероциклических соединений (фуран, пиррол, тиофен, индол и др.) используют комплексы SO3 с диоксаном или пиридином. Эти же реагенты применяют для сульфирования алифатических соединений, содержащих сильные электроноакцепторные группы; при этом образуются, как правило, a‑сульфопроизводные:
![]()
X = СНО, COR:, COOH, CN, NO2, SO3H и др.
Повышение СН-кислотности алифатических соединений способствует тому, что последующее сульфирование протекает более однозначно, чем моносульфирование. Например, ацетальдегид и уксусная к-та с высоким выходом образуют соответствующие да- и трисульфосоединения:
СН3СНО + 2SO3·Диоксан: (HSO3)2CHCHO
![]()
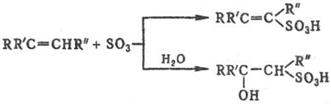
Легко реагируют с SO3 и его комплексами алкены, которые образуют в зависимости от структуры и условий b- или d‑сультоны (см. Сулътоны) либо a, b- или b, g‑ненасыщ. сульфокислоты, а также b‑гидроксисульфокис-лоты, напр.:
Прямое С. алканов протекает с трудом и сопровождается, как правило, окислением. Подобные р-ции редко используют для препаративных целей, но находят им практич. применение для С. полимеров, напр. полиэтилена, с целью их модификации. Значительно легче сульфируются углеводороды при совместном действии SO2 и О2 (сульфо-окисление), а также SO2 и Сl2 (сульфохлорирование). Обе р-ции имеют радикальный характер и инициируются пе-роксидами, УФ или g‑облучением:
![]()
Эти процессы имеют важное значение в пром. произ-ве ПАВ.
Для С. орг. соединений широко используют H2SO3 и ее производные. Гидросульфиты присоединяются к альдегидам и кетонам (р-ция 1), а также в условиях радикального инициирования к алкенам и алкинам (2,3); взаимод. с трифенил- и три (n‑толил) карбинолами (4); реагируют с оксиранами, тииранами с раскрытием кольца (5):
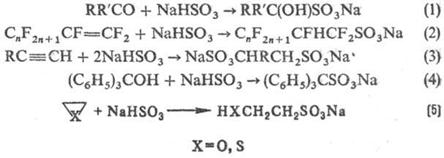
Диазоалканы сульфируют SO2 в присутствии воды, спиртов, тиолов и аминов (6), последоват. действие SO2 и галогена на реактивы Гриньяра приводит к сульфонил-галогенидам (7):
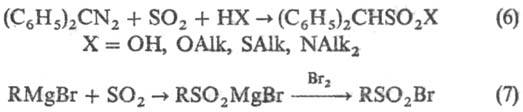
К косвенным методам С. относят сульфометилирование, сульфоэтилирование и т.д., напр.:
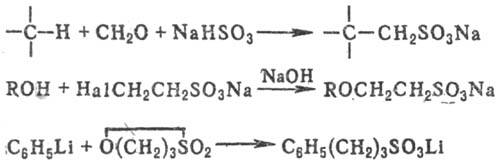
Амины. N‑ОКСИДЫ (N‑окиси аминов).
Производные третичных аминов и гетероароматич. соединений, содержащие семиполярную связь![]() –О- Большинство хорошо раств. в воде, ограниченно-в неполярных орг. р-рителях. Образуют с к-тами устойчивые кристаллич. соли
–О- Большинство хорошо раств. в воде, ограниченно-в неполярных орг. р-рителях. Образуют с к-тами устойчивые кристаллич. соли
R3![]() OHX- Расположение четырех заместителей у атома азота тетраэдрическое.
OHX- Расположение четырех заместителей у атома азота тетраэдрическое.
Свойства n‑оксидов аминов
|
Показатель Т. пл., °С |
(СН3Ь |
С6Н5(СН3)2 |
С5Н5 |
|
Т. кип., °С |
– |
154,0 |
100* |
|
|
16,7 |
16,15 |
14,11 |
|
рКа |
4,65 |
4,21 |
1,90 |
|
Потенциал полуволны восстановления, В |
-0,456 |
-0,705 |
– 1,278 |
|
v( |
930–970 |
– |
1230–1320 |
