Методы отделения и выделения следов элементов
Немногие из применяемых в колориметрии реактивов обладают достаточной избирательностью для определения элемента непосредственно в присутствии сопутствующих элементов, когда соотношения между ними и определяемым элементом неблагоприятны, как это имеет место при анализе следов. По возможности элементы, мешающие определению, «нейтрализуют» регулированием рН раствора, добавлением комплексообразующих реагентов, окислением или восстановлением до другого валентного состояния; если же такие средства не помогают, следует прибегнуть к отделению. Даже в тех случаях, когда мешающие элементы отсутствуют, часто необходимо, особенно при определении ничтожно малых количеств вещества, выделить определяемый элемент тем или иным путем так, чтобы получить его в малом объеме раствора.
В процессе разделения, очевидно, важны два фактора: полнота извлечения выделяемого вещества и степень отделения его от других веществ. Степень извлечения для данного процесса выражается отношением
![]()
где
o - количество вещества;
А в образце;
QA – выделенное количество вещества.
При желании извлечение можно выразить в процентах. Извлечение, равное 9096, иногда можно считать достаточным при анализах образцов, в которых содержание определяемого компонента составляет 0,0001–0,001% или даже 0,01%; 95%-ное извлечение обычно считают удовлетворительным, хотя всегда желательна более высокая степень извлечения.
Степень отделения вещества В определяется как величина, на которую нужно помножить первоначальное отношение В к А, чтобы получить конечное отношение:
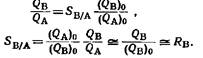
Требуемая степень отделения, конечно, зависит от отношения В к А в в исходной пробе и от допустимого значения Qb/Qa – Если А и В одинаково чувствительны к реагенту, используемому для определения А, то для Qb/Qa допустимо значение от 0,01 до 0,05 в зависимости от требуемой точности. Поскольку отношение o/o может иметь значение 100 000 и более, при анализе следов может потребоваться степень отделения 10~в или даже 10~.
1. Методы осаждения, соосаждения, адсорбции и связанные с ними процессы
Все эти методы имеют общую особенность: раствор пробы подвергается такой обработке, в результате которой образуются две фазы: одна – раствор, содержащий макрокомпоненты пробы, другая – твердая фаза, которая целиком или частично состоит из определяемого вещества. Схему процесса можно представить следующим образом:
![]()
где С – фаза, содержащая макрокомпоненты пробы; с – фаза, содержащая микрокомпонент, который подлежит определению. Процессы, посредством которых можно вызвать представленное выше фазовое изменение, различны. Характерные особенности некоторых из них будут рассмотрены. Классификация процессов, принятая в дальнейшем, по общему признанию, несколько искусственна, однако цель ее состоит в том, чтобы ориентировочно разбить процессы по группам.
а. химическое осаждение и аналогичные процессы
Наиболее простой процесс заключается в осаждении следов определяемого вещества реактивом, который оставляет макрокомпоненты в растворе. Однако осаждение в его простой форме обычно не применимо, когда концентрация определяемого микрокомпонента очень низка. Даже если осадок имеет очень низкую растворимость, его определение может быть связано с трудностями, учитывая, что абсолютное количество осадка мало. Возможны и другие осложнения – образование коллоидальной суспензии или пересыщенного раствора, в котором не происходит выпадения осадка, и т.д. В связи с этим к раствору добавляют небольшое количество другого вещества, образующего с осадителем малорастворимый продукт. Осадок, образовавшийся из добавленного вещества, называют носителем – термином, который весьма точно описывает его функции.
Иногда носитель функционирует более или менее механическим путем. Так, например, когда соль алюминия добавляют к раствору четырехвалентного титана, разбавленному до такой степени, что титан не реагирует даже с тимолом, а затем осаждают алюминий аммиаком, то гидроокись алюминия, выпадая в осадок, увлекает из раствора гидроокись титана, и титан можно определить колориметрически в осадке после его растворения. Этим способом можно определить количество титана порядка 1 у/л.
Носители часто требуются для осаждения сульфидов. Сульфид меди использовали в качестве носителя для молибдена, цинка, свинца, сурьмы и других металлов; сульфид свинца применяли для осаждения меди, сульфид серебра – для осаждения свинца и т.д. Иногда сульфидный носитель функционирует в основном физическим путем, но часто имеет место дополнительный эффект, обусловленный действием процессов, которые называют соосаждением. Например, между носителем и осадком следов вещества могут образоваться смешанные кристаллы. Кроме того, носитель может способствовать осаждению микрокомпонента из его перенасыщенного раствора.
Полнота выделения данного металла путем сульфидного осаждения, естественно, зависит в значительной степени от растворимости его сульфида, особенно если носитель не образует смешанных кристаллов с осаждаемым сульфидом.
Сульфид свинца, который имеет произведение растворимости 3,4–10», нельзя осадить количественно из кислого раствора даже в том случае, если используется такой носитель, как сульфид серебра. Можно вычислить, что ионная растворимость сульфида свинца в 1 н. кислом растворе, насыщенном сероводородом, составляет 3–10 М, что соответствует около 6 мг/л РЬ\ В 0,1 н. растворе кислоты, насыщенном сероводородом, расчетная растворимость Рh равна 0,06 мг/л; это все же довольно большая величина с точки зрения аналитика, определяющего следы веществ. В действительности кажущаяся растворимость может быть больше, чем указывают вычисления, потому что в сульфидной системе металл – водород равновесие устанавливается медленно. Одна из функций носителя состоит в том, чтобы ускорять достижение равновесия. Тем не менее, при осаждении следов сульфидов рекомендуется перед фильтрованием дать постоять раствору в течение ночи; кроме того, кислотность раствора должна быть не выше, чем необходимо для удержания других металлов в растворе.
Другая причина, предостерегающая от переоценки значений растворимостей, вычисленных из произведений растворимости, заключается в том, что определяемый металл может присутствовать в иных, чем простая ионная, формах. Так, например, установлено, что растворимость ртути в 1 М хлорной кислоте, насыщенной сероводородом, благодаря образованию HoHgS, равна 3–10 М. Даже если никакого комплексного сульфида не образуется, несомненно, что в растворе будет присутствовать некоторое количество металла в виде молекулярного сульфида, концентрация которого вполне может превосходить ионную концентрацию, когда последняя очень мала. Применение носителя позволяет преодолеть ограничения, связанные с растворимостью при осаждении ртути. Из 1 л раствора осаждением сероводородом в присутствии меди можно выделить такие количества ртути, как 0,02 у. Иногда слаборастворимые металлоорганические комплексы используют для осаждения следов других металлов, образующих нерастворимые соединения с тем же самым реагентом. Следы циркония, ванадия и титана, встречающиеся в минеральных водах, можно количественно выделить с осадком купферроната железа, образующегося при добавлении купферрона. 8-Оксихинолин также был использован для осаждения следов различных металлов с хинолятами железа или алюминия в качестве носителей.
