Методы синтеза винильных мономеров
В результате взаимодействия винилацетата с эфирами пиразол-3карбоновой и пиразол-3,4-дикарбоновой кислот также получают соответствующиеN-винильные производные. В реакцию перевинилирования вступает индазол, проявляющий таутомерию, в результате чего имеет место образование только 2-винилизомера. Подобным образом из 6-нитроиндазола синтезируют его N-винильное производное.
Алкиловые эфиры 3-индазолкарбоновой кислоты достаточно активны в реакции с винилацетатом и винилбутиловым эфиром. Как и в большинстве реакций перевинилирования, катализатором здесь может быть ацетат ртути. В качестве сокатализатора предложен эфират трехфтористого бора, а при использовании винилбутилового эфира - фенилуксусная кислота. Поскольку для эфиров 3-индазолкарбоновой кислоты характерны таутомерные превращения, протекание реакции возможно в двух направлениях:
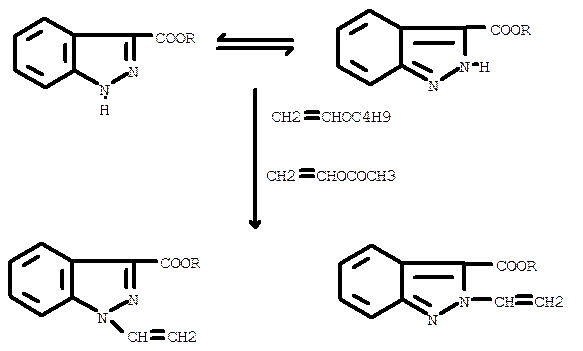
Имеются данные о синтезе реакцией перевинилирования винильных производных 1,2,4-трназола и его замещенных, Взаимодействием 1,3,4-триазола с винилацетатом в присутствии ацетата ртути и моногидрата серной кислоты синтезируют с невысоким выходом 1-винил-1,2,4-триазол. При винилировании винилбутиловым эфиром I-оксиэтил-1,2,4-триазола образования винилового эфира в отличие от 1-оксиэтил-1,2,З-тиразола не наблюдается. При этом, как установлено, исходное вещество теряет оксиэтильную группу и образуется 1-винил-1,2,4-триазол. Подобно аналогичному производному, с 1,2,3-триазольным циклом оксиэтильное замещенное 1,2,4-триазола не реагирует с винилацетатом. Синтез винилового эфира 1-оксиэтил-1,2,4-триазола возможен лишь при использовании в реакции хлорэтилвинилового эфира и 1,2,4-триазола. Реакция образования 1-(3-окса-4-пентен-1-ил)-1,2,4-триазола не сопровождается выделением побочных веществ, и выход винилового эфира достигает 50%.
В реакцию перевинилирования вступают тетразол и его замещённые:
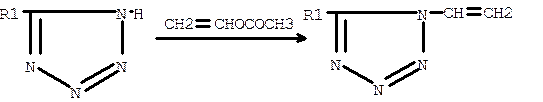
Реакцию ведут при 317-328 К в присутствии ацетата ртути и уксусной кислоты. Полученное соединение с выходом 60-68% легко отделяют перегонкой от присутствующих в небольших количествах вторых изомеров.
Дегидрогалогенирование β-галогенэтильных замещённых
Один из способов синтеза винильных производных азолов состоит в дегидрогалогенировании β -галогенэтильных замещенных. Отщепление галогенводородов, которое приводит к получению С- и N-винильных соединений, дает чаще всего при нагревании в присутствии алкоголятов щелочных металлов, их гидроксидов и некоторых других дегидрогалогенирующих средств. Синтезу винильных производных обычно предшествуют реакции, в результате которых получают оксиэтильные и галогенэтильные замещённые. Общая схема таких превращений часто включает следующие стадии:
RCH2CH2OH -- ![]() RCH2CH2X --
RCH2CH2X -- ![]() RCH=CH2
RCH=CH2
R- азолил, X- галоген.
Разработаны такие способы косвенного ввинилирования, в которых стадия синтеза оксиэтильного производного не является обязательной. Отщепление галогенводородов большей частью проходит легко и, хотя реакция может сопровождаться образованием побочных веществ, выход целевых винильных производных бывает достаточно высоким. С помощью реакции дегидрогалогенирования получают винилазолы с различными азольными циклами. При синтезе 2- винилимидазола в качестве промежуточных веществ получают2-(2’-оксиэтил)- и 2-(2’-бромэтил) имидазолы. Подобным образом синтезируют и 2-винилбензимидазол.
В последние годы разработаны достаточно эффективные способы синтеза винилмеркаптобензазолов с имидазольным, оксазольным и тиазольным циклами. При этом хлорэтильные замещённые, используемые при гидрохлорировании, получают из азолов и 1,2-дихлорэтана. Стадия синтеза веществ с гидроксильной группой в этом случае отсутствует. Такие превращения проводят по схеме:
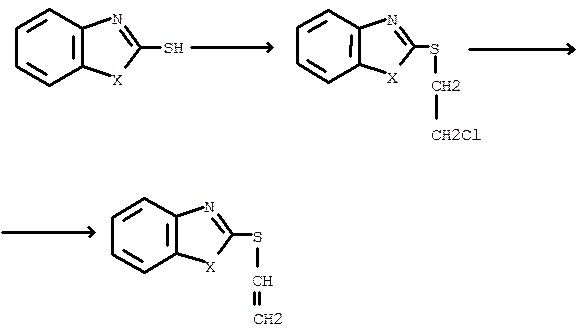
X=O,S,NH.
Хлорэтильные замещённые получают из натриевого или калиевого производного 2-меркаптобензола и многократного избытка 1,2-дихлорэтана в воде, а реакцию дегидрохлорирования осуществляют в спиртовом растворе KOH или трет-бутила калия при 303-313 К.
Дегидротация β-оксиэтильных производных
Оксиэтильные производные азолов часто используют в качестве промежуточные соединений в синтезе винильных производных методом дегидрогалогенирования. Однако получают винилазолы с помощью реакции дегидратации по сравнению с многостадийным дегидрогалогенированием редко, хотя этим методом можно было бы синтезировать целевые вещества при меньшем числе промежуточных стадий. Объясняется это тем, что отщепление воды в отличии от отщепления галогенводородов чаще всего проходит в более жестких условиях, а это приводит к различного рода побочным реакциям и деструкции. Способность к дегидротации зависит от строения используемого в таком процессе вещества и условий проведения реакции.
Методом дегидротации синтезируют винилпиразолы с заместителями в различных положениях цикла. В частности, получение 1-винил и 3,5-диметил-1-винилпиразолов проводят из соответствующих спиртов, которые синтезируют из тетраэтоксипропана и ацетилацетона с β-оксиэтилгидразином:
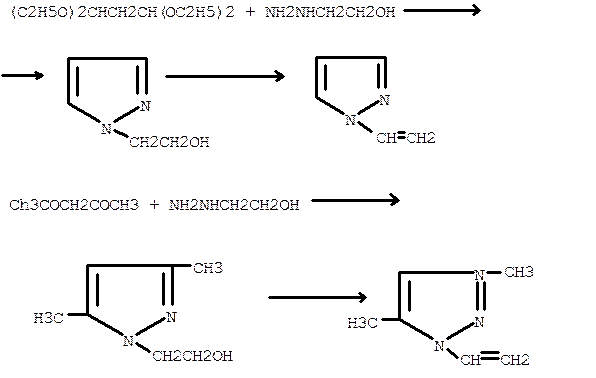
Гетероциклизация
Многие способы синтеза винилазолов и их замещенных основами на реакциях циклоприсоединения и циклизации. Комбинируя структуру веществ, используемых в таких превращениях, можно получать винильные производные азолов с различными гетероциклами и заместителями. Одной из распространенных реакций является 1,3-диполярное циклоприсоединение.
Для синтеза винильных производных пиразола, индазола и их замещенных реакцию циклоприсоединения осуществляют между диазо-алканами и соединениями, содержащими тройные углерод-углеродшые связи. Превращения такого типа рассматриваются в основном как процесс 1,3-диполярного циклоприсоединения, в котором диазо-соединения выполняют роль 1,3-диполя, а ацетиленовые вещества служат диполярофилами:
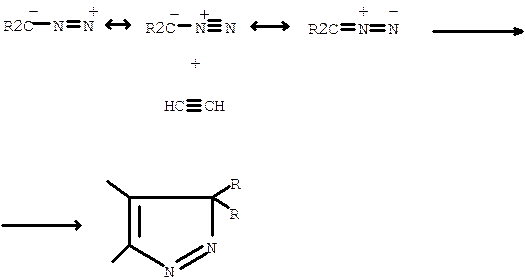
Циклоприсоединение винилдиазометана к активированным ацетиленам приводит к получению с высоким выходом ряда 3(5)-винилпиразолов. Симметрично замещенные диацетилены (диины) в реакциях с диазо-алканами обычно дают моно- и дипродукты. В отдельных случаях реакция осуществляется только в сторону диприсоединения. Это происходит, например, в реакции винилдиазометана с пентадииноном:
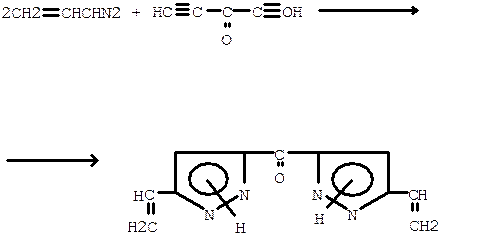
Применяя в реакции с винилдиазометаном такие диполярофилы, как 1,4- бензохиноны, синтезируют 3-винилиндазолхиноны. Если же используют1,4-нафтохиноны, то образуется 3-винилпиразолнафтохиноны:
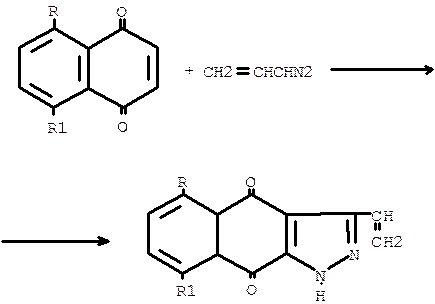
R = R1 = OH; R = R1 = OAc; R = OH, R1 = H.
Изучение циклизации винилдиазометана с метилакриалатом и акрилонитрилом показало, что в реакции с акрилатом образуется метиловый эфир 5-винил-2-пиразолин-3-карбоновой кислоты, а с акрилонитрилом – 5-винил-3-циан-2-пиразолин:
