Мир солей
|
Бромоводородная HBr |
Br- |
I |
бромиды |
NaBr бромид натрия |
|
Иодоводородная HI |
I- |
I |
иодиды |
KI иодид калия |
|
Сероводородная H2S |
S2- |
II |
сульфиды |
FeS сульфид железа (II) |
|
Соляная HCl |
Cl- |
I |
хлориды |
NH4Cl хлорид аммония |
|
Фтороводородная HF |
F- |
I |
фториды |
CaF2 фторид кальция |
Из таблицы 1 видно, что названия кислородсодержащих солей имеют окончания "ат", а названия бескислородных солей – окончания "ид".
В некоторых случаях для кислородсодержащих солей может использоваться окончание "ит". Например, Na2SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H2SO4) и сернистой кислоты (H2SO3) и в других таких же случаях.
В таблице 2 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение.
Таблица 2. Международные, русские и традиционные названия некоторых важных солей.
|
Соль |
Международное название |
Русское название |
Традиционное название |
|
Na2CO3 |
Карбонат натрия |
Натрий углекислый |
Сода |
|
NaHCO3 |
Гидрокарбонат натрия |
Натрий углекислый кислый |
Питьевая сода |
|
K2CO3 |
Карбонат калия |
Калий углекислый |
Поташ |
|
Na2SO4 |
Сульфат натрия |
Натрий сернокислый |
Глауберова соль |
|
MgSO4 |
Сульфат магния |
Магний сернокислый |
Английская соль |
|
KClO3 |
Хлорат калия |
Калий хлорноватокислый |
Бертолетова соль |
Графическое изображение формул солей
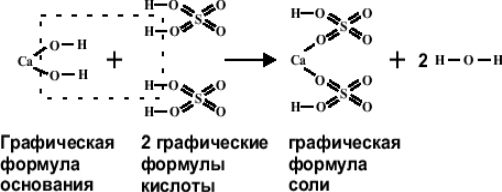
Для того чтобы изобразить формулу соли графически, следует:
- Правильно написать эмпирическую формулу этого соединения.
- Учитывая, что любая соль может быть представлена как продукт нейтрализации соответствующей кислоты и основания, следует написать формулы кислоты и основания, образовавших данную соль. Например, гидросульфат кальция Сa(HSO4)2 можно получить при нейтрализации серной кислоты H2SO4 гидроксидом кальция Ca(OH)2.
- Определить, какое количество молекул кислоты и основания требуется для получения молекулы этой соли. Например, для получения молекулы Ca(HSO4)2 требуется одна молекула основания (один атом кальция) и две молекулы кислоты (два кислотных остатка HSO4).
- Построить графические формулы установленного числа молекул основания и кислоты и, мысленно убрав участвующие в реакции нейтрализации и образующие воду анионы гидроксила основания и катионы водорода кислоты, получить графическое изображение формулы соли:
Классификация солей
Любую соль можно представить как продукт взаимодействия основания и кислоты, то есть как продукт замещения атомов водорода в молекуле кислоты на атом металла или гидроксильных групп в молекуле основания на соответствующие кислотные остатки. В зависимости от состава различают следующие типы солей: средние, кислые, основные, двойные и комплексные.
1. Кислые соли
Кислые соли - представляют собой продукты неполного замещения атомов водорода атомами металла. Кислые соли - продукт неполной нейтрализации многоосновных кислот основаниями.
От двухосновных кислот (H2SO4, H2CO3, H2Sи т.д.) производится только один тип кислых солей - однозамещенные (атом металла замещает только один атом водорода кислоты).
Например:
H2SO4 при неполной нейтрализации едким натром образует только одну кислую соль - NaHSO4 .
От трехосновных кислот можно получить уже два типа кислых солей: однозамещенные и двухзамещенные.
Например:
при нейтрализации H3PO4 едким натром можно получить однозамещенную соль NaH2PO4:
H3PO4 + NaOH = NaH2PO4 + H2O
и двухзамещенную сольNa2HPO4:
H3PO4 + 2NaOH = Na2HPO4 + 2 H2O
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку "гидро" (от слова hydrogenium – водород). Например:
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
