Общие свойства молекулярных орбиталей
![]() jA =(s1+s2+s3)/31/2 невырожденный уровень A
jA =(s1+s2+s3)/31/2 невырожденный уровень A
![]() jE’ =(s1+s2-2s3)/61/2 дважды вырожденному уровню E
jE’ =(s1+s2-2s3)/61/2 дважды вырожденному уровню E
jE” =(s1-s2)/21/2 соответствуют 2 орбитали
Пример (кратко о бутадиене):
Корни ВД и уровни -МО: X1,2,3,4= ± (1 ± 51/2)/2.
(E1,4, E2,3)=(±=±).
Матрица нормированных составов МО построена всего из двух чисел:
(0.3717; 0.6015)
Профильные диаграммы амплитуд МО.
Уровни. Конфигурация. Числа заполнения.
Минимальное понятие о топологии молекулярной структуры: центры-атомы, рёбра-связи. Индексы электронной структуры:
Атомные: Заселённости АО парциальные и полные.
Для связей: Заселённости связей (порядки связей) парциальные и полные. Полные порядки пи-связи равны (2´2´ab; 2´(a2-b2);)=(0.894; 0.263) » (0.9; 0.3) Хюккелевские порядки связей. Порядок связи и длина (корреляия).
|
|CC|, Ao |
pp |
Молекула |
Примечание |
|
1.54 |
0 |
Этан | |
|
1.45 |
0.5 |
Графит |
Экстрапол. по – C< |
|
1.397 |
2/3 |
Бензол | |
|
1.33 |
1 |
Этен | |
|
1.22 |
2 |
Этин |
Свободные валентности
Индекс свободной валентности (у бутадиена): F1,4=31/2-0.9»0.8; F2,3=31/2-0.9-0.3»0.5.
Альтернантные УВ и две теоремы об АУВ: 1) Уровни. 2) Заселённости АО. Сопряжение и Ароматичность. Алкены. Арены. Алкины. Длина связи CC.
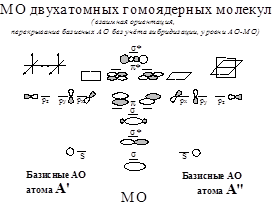
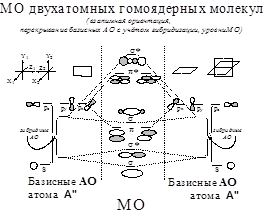
Двухатомные гомоядерные молекулы. Гибридизация орбиталей: -модельный случай у плоского ротатора. Кривая зависимости ПИ(Z) для 2s-2p АО и гибридизация (s±p)-АО у атомов элементов 2-го периода. Пиктограммы гибридных АО.
Две корреляционные схемы уровней АО-МО у элементов 2-го периода
(атомы и 2-х атомные молекулы).
Схема А: Вариант с гибридизацией АО,
Схема Б: Вариант без гибридизации АО.
Последовательности уровней МО:
Схема А:1g<1u<2g<2u<1u<3g<1g<3u
Схема Б: 1g<1u<2g<2u<3g<1u<1g<3u
Конфигурации и параметры 2-х атомных молекул и молекулярных ионов.
Дистанции E(2s)-E(2p) у элементов 2-го Периода Системы Менделеева
|
H |
Li |
Be |
B |
C |
N |
O |
F |
Ne | |
|
Z |
1 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
1-й ПИ, эВ |
13.62 |
5.377 |
9.281 |
8.28 |
11.23 |
14.48 |
13.57 |
17.37 |
21.509 |
|
ЭС, эВ |
0.747 |
0.82 |
-0.19 |
0.38 |
2.1;1.12 |
0.05 |
1.465 |
3.58;3.50 |
- |
|
E2s2p, эВ |
теор. |
1.85 |
3.36 |
5.76 |
8.77 |
12.39 |
16.53 |
21.54 |
График этой зависимости имеет вид гладкой функции.
Она очень неплохо аппроксимируется параболой: E=A+BZ+CZ2
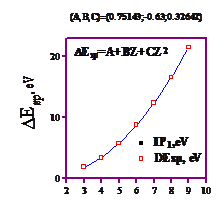
|
| ||||
| ||||
ПРОБЛЕМЫ: Связь и разрыхление. Длины связей. Энергии связи. Силовые постоянные собственных колебаний. Устойчивость конфигураций. Баланс «связь-разрыхление» и кратность связи по Герцбергу: PГ=(1/2)´ (n-n*).
Свойства гомоядерных двухатомных молекул элементов 2-го периода Системы Менделеева