Окислительно-восстановительные реакции органических веществ
Ответ: Скорость реакции увеличится в 27 раз.
222. Как повлияет на выход хлора в системе :
4 HCl(г) + О2(г) « 2 Cl2(г) + 2 Н2О(ж), Q = 202,4 кДж,
а) повышение температуры в системе,
б) уменьшение общего объема смеси,
в) уменьшение концентрации кислорода,
г) увеличение общего объема реактора,
д) введение катализатора?
Решение:
4HCl(г) + О2(г) « 2Cl2(г) + 2Н2О(ж), Q = 202,4 кДж
Прямая реакция происходит с выделением тепла, т.е. является экзотермической (Q > 0), следовательно, обратная реакция будет протекать с поглощением тепла, т.е. является эндотермической (Q < 0). Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.
а) повышение температуры в системе будет способствовать сдвигу равновесия в сторону реакции, протекающей с поглощением тепла (эндотермической), т.е. в сторону реакции образования исходных веществ – выход хлора при этом уменьшится.
б) уменьшение общего объема смеси приведет к смещению равновесия в сторону реакции, протекающей с образованием меньшего числа молей газообразных веществ, т.е. в сторону прямой реакции – выход хлора при этом увеличится.
в) при уменьшении концентрации кислорода равновесие сдвигается в направлении образования исходных веществ – выход хлора при этом уменьшится.
г) при увеличении общего объема реактора давление в системе уменьшится, потому равновесие сдвинется в сторону увеличения числа газовых молей, т.е. в сторону обратной реакции – выход хлора при этом уменьшится.
д) катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывает, а только способствует более быстрому его достижению, поэтому введение катализатора на выход хлора не повлияет.
237. Составьте схему, напишите уравнения электродных процессов гальванического элемента, у которого один электрод цинковый с концентрацией ионов цинка 10-2 моль/л, а второй – водородный с концентрацией ионов водорода 10-2 моль/л. Рассчитайте э.д.с. этого элемента.
Решение:
Схема химической цепи:
поток электронов
![]()
![]()
Электрод восстановитель (донор электронов) Электрод окислитель (акцептор электронов
![]()
где ![]() и
и ![]() – соответственно потенциалы положительного и отрицательного электродов.
– соответственно потенциалы положительного и отрицательного электродов.
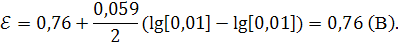
Ответ: Э.Д.С. равно ![]() .
.
262. Напишите уравнения реакций процессов, протекающих на электродах при электрохимической защите стальных труб.
Решение:
Одним из вариантов электрохимической защиты стальных труб есть протекторная защита. Если в качестве протектора взять цинк, то уравнения реакций процессов, протекающих на электродах будут следующие:
анодный процесс:
Zn – 2e- = Zn2+;
катодный процесс: в кислой среде –
2Н+ + 2е- = Н2↑;
в нейтральной среде –
1/2О2 + Н2О + 2е- = 2ОН-.
286. Вычислить рН 0,001 М раствора фтористоводородной кислоты и 0,00001 М раствора гидроксида натрия.
Решение:
Электролиты HF и NaOH есть сильными и потому в растворе диссоциируют полностью.
Для указанных растворов имеем:
![]()
![]()
![]()
![]()
Ответ: 3 и 9.
312. Слили 30 г 2 %-ного раствора ацетата свинца Pb(CH3COO)2 и 50 мл 1 М раствора иодоводородной кислоты HI. Определите массу осадка иодида свинца.
Решение:
Уравнение реакции:
![]()
в уравнении ![]() .
.
Теперь рассчитаем какой реагент в избытке:
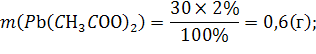
![]() =
=![]()
![]()
– находится в избытке, расчеты ведем по
![]() ; так как
; так как ![]() , то
, то
![]()
Ответ: ![]() .
.
337. В 70 г бензола С6Н6 растворено 2,09 г некоторого вещества. Раствор кристаллизуется при 4,250С. Установить молекулярную массу растворенного вещества. tкрист.бензола= 5,50С.
Решение:
Криоскопическая константа выражается формулой
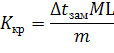
где Ккр – криоскопическая константа; ![]() – величина, получаемая опытным путем – понижение точки замерзания раствора, состоящего из т кг растворенного неэлектролита и L кг растворителя; М – масса 1 моль неэлектролита, кг. Криоскопическая константа бензола Ккр = 5,1°.
– величина, получаемая опытным путем – понижение точки замерзания раствора, состоящего из т кг растворенного неэлектролита и L кг растворителя; М – масса 1 моль неэлектролита, кг. Криоскопическая константа бензола Ккр = 5,1°.
Отсюда
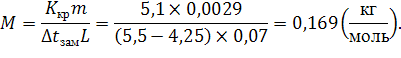
Ответ: ![]() .
.
