Основные задачи термохимии. Использование калориметрических методов для определения теплот растворения солей
Приведенные рассуждения включают ряд допущений, в действительности поведение растворов часто значительно сложнее. Например, конечный раствор представляет собой систему с совершенно случайным распределением частиц, при рассмотрении которой была исключена возможность существования в растворе некоторой упорядоченной структуры. Если наличие упорядоченной структуры вносит свой вклад в образование раствора, то изменение энтропии будет иметь меньшее положительное значение, которое трудно поддается анализу. Тем не менее корреляция положительных отклонений от поведения идеальных растворов и ограниченной растворимости с энергиями притяжения между однородными частицами является достаточно хорошим первым приближением.
Образование раствора может продолжаться до тех пор, пока химические потенциалы компонентов заметно понизятся при переходе в раствор. Теоретическая модель процесса растворения объясняет понижение химического потенциала как результат разупорядочения при смешении частиц и влияния энергетических эффектов за счет притяжения между частицами. Если энергия притяжения между однородными частицами больше энергии притяжения между разнородными частицами, то снижение химического потенциала велико только для очень разбавленных растворов, а затем становится незначительным. Тогда можно предсказать, будут ли два вещества обладать высокой или низкой взаимной растворимостью; для этого необходимо только оценить степень притяжения между однородными частицами.
Теплоты испарения служат удобной и достаточно достоверной мерой энергии притяжения, хотя следует иметь в виду вклады других факторов, таких, как размеры молекул и специфические взаимодействия между частицами. В общем, два компонента будут обладать ограниченной взаимной растворимостью, если один из них характеризуется значительно большей теплотой испарения по сравнению с другим.
При смешении двух жидкостей могут наблюдаться всевозможные градации взаимной растворимости: от практически полной нерастворимости друг в друге (например, ртуть и вода) до смешения в любых соотношениях с образованием однородного раствора (например, этанол и вода). Промежуточное положение занимает смесь ограниченной взаимной растворимости. Смесь жидкостей А и В (например, анилин и вода) разделяется после взбалтывания на два слоя: насыщенный раствор А в В и насыщенный раствор В в А. Однако и в этом случае могут существовать области температуры и состава, в которых компоненты А и В образуют однородную смесь.
Термохимические изменения
Ввиду разнообразия в поведении растворы классифицируют в соответствии с их термодинамическими свойствами. С этой точки зрения различают идеальные и неидеальные растворы. Для большинства физико-химических расчетов необходимо знать теплоемкости веществ, участвующих в процессе, тепловые эффекты процессов растворения, фазовых превращений и химических реакций. Эти величины можно измерить экспериментально. При температурах, близких к комнатной (20-50оС), широко применяется калориметрический метод.
При калориметрических опытах величина и знак теплового эффекта Q процесса определяются по изменению температуры калориметра Dt:
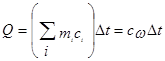 (1)
(1)
где mi – масса исследуемого вещества, калориметра и вспомогательных устройств (мешалки, ампулы, термометра); c – удельные теплоемкости исследуемого вещества, калориметра и вспомогательных устройств; сw - суммарная теплоемкость калориметрической системы. Уравнение (1) может быть записано
Q=(K+m1c1)Dt
где K – константа калориметра, то есть теплоемкость частей калориметра и вспомогательных устройств, участвующих в теплообмене, Дж/К; с1 – теплоемкость содержимого калориметра; Dt – изменение температуры процесса, протекающего в условиях отсутствия теплообмена калориметра с окружающей средой.
Калориметр с изотермической оболочкой (диатермический) позволяет учесть теплообмен его с окружающей средой, что дает возможность вычислить изменение температуры Dt, соответствующее опыту без теплообмена.
Теплоемкость систему С называют производную dQ/dT. Теплоемкость газов и жидкостей зависит от температуры, а теплоемкость твердых веществ при средних и высоких температурах практически от нее не зависит. При расчетах часто использую теплоемкость.
Средней теплоемкостью однородного тела называют отношение подведенной теплоты к повышению температуры:
![]()
Средняя теплоемкость ![]() зависит от интервала температур (Т2 – Т1). Зависимость между истинной и средней теплоемкостями выражается уравнением
зависит от интервала температур (Т2 – Т1). Зависимость между истинной и средней теплоемкостями выражается уравнением
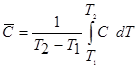
При DТ£5о даже на совершенных калориметрах (при измерении с точностью 0,05%) не удается установить различия между истинной и средней теплоемкостью. Поэтому теплоемкость, определенную в результате изменения температуры калориметра на 2-3о, принимают за истинную и относят ее к температуре (Т2+Т1)/2. Теплоемкость однородного тела зависит от его массы:
С=сm или ![]() ,
,
где ![]() удельная теплоемкость вещества; m – масса вещества. Если масса равна молярной или атомной массе, то теплоемкость будет соответственно молярной или атомной. Если во время опыта давление в калориметрической системе остается постоянным (в калориметрах открытого типа оно равно атмосферному), то тепловой эффект процесса при постоянном давлении будет Qр, а теплоемкость Ср. При термохимических изменениях процессам, сопровождающимся выделением теплоты (экзотермическим процессам), приписывается положительный знак. При выделении системной теплоты ее энтальпия убывает. Откуда Qр=-DH. Если в уравнениях тепловой эффект обозначен Q или q, то следует применять термохимическую систему знаков.
удельная теплоемкость вещества; m – масса вещества. Если масса равна молярной или атомной массе, то теплоемкость будет соответственно молярной или атомной. Если во время опыта давление в калориметрической системе остается постоянным (в калориметрах открытого типа оно равно атмосферному), то тепловой эффект процесса при постоянном давлении будет Qр, а теплоемкость Ср. При термохимических изменениях процессам, сопровождающимся выделением теплоты (экзотермическим процессам), приписывается положительный знак. При выделении системной теплоты ее энтальпия убывает. Откуда Qр=-DH. Если в уравнениях тепловой эффект обозначен Q или q, то следует применять термохимическую систему знаков.
Калориметрическая установка (диатермический калориметр).
Калориметрическая установка состоит из воздушного термостата и помещенного в нем калориметра. Термостат представляет собой бокс с застекленными стенками, в котором установлены нагреватель, вентилятор, термохимический и контактный термометры. Нагреватель выключается при помощи реле при достижении в боксе заданной температуры. В качестве нагревателя используется электрическая лампочка, обладающая малой тепловой инерцией. Температура в боксе поддерживается с точностью ±0,02°. Воздушная среда в боксе с постоянной температурой является изотермической оболочкой калориметра.
Калориметр состоит из калориметрического сосуда (полиэтиленовый стакан). Через отверстия в крышке бокса в калориметре крепятся стеклянная мешалка, термометр Бекмана, электронагреватель и ампула с исследуемым веществом. Калориметр устанавливается в боксе на столике, перемещающемся вертикально. Электронагреватель питается от электросети через стабилизатор и трансформатор. Число оборотов вентилятора и мешалки регулируют лабораторными автотрансформаторами. Напряжение в электронагревателе регулируют реостатом. Отсчеты времени производятся с помощью звукового сигнализатора, подающего сигналы через каждые 30 с. Тепловой баланс процесса в калориметрическом опыте выражается уравнением
