Особенности кинетики реакций на поверхности гетерогенных катализаторов
Рассмотрим подробнее применение закона действия масс для реакций на поверхности. Для описания скорости элементарной стадии используют закон действия поверхностей. Если процесс определяется скоростью реакции двух поверхностных интермедиатов (Аадс + Вадс →, ZA + ZB →, 2ZA →) скорость такой стадии, например,
![]() (27)
(27)
запишем через концентрации поверхностных веществ ![]() и
и ![]() (моль/м2)
(моль/м2)
![]() моль·м–2·сек–1 (28)
моль·м–2·сек–1 (28)
Удельная скорость стадии (на 1 г катализатора)
![]() моль·г–1·сек–1 (29)
моль·г–1·сек–1 (29)
где S – удельная поверхность, м2/г.
Выразим величины ![]() и
и ![]() через относительные концентрации, доли занятой поверхности
через относительные концентрации, доли занятой поверхности
![]()
![]()
где ![]() – максимальная концентрация поверхностных центров, занимаемых молекулами А, В или С. Тогда
– максимальная концентрация поверхностных центров, занимаемых молекулами А, В или С. Тогда
![]() (30)
(30)
Зная насыпную плотность катализатора (G, г/л), можно пересчитать скорость в молях на 1л катализатора в сек. В жидкофазных процессах с твёрдым катализатором обычно используют значения скорости на 1л раствора. Тогда G есть количество грамм тв. катализатора в 1л раствора
R = WG = kΘAΘB, моль·л–1·сек–1, (31)
где ![]() .
.
Для однородной поверхности скорость реакции легко записать, выразив ΘA и ΘB через концентрации или парциальные давления реагентов А и В. В случае квазиравновесного приближения
![]() (32)
(32)
(изотерма Лэнгмюра). Тогда, для стадии (27) получим
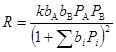 (33)
(33)
Такой тип уравнений называют уравнениями (или моделью) Лэнгмюра – Хиншельвуда и часто используют для описания кинетики гетерогенного катализа при решении прикладных задач. Кинетику реакций на неоднородных поверхностях рассмотрим в следующем разделе.
Методы вывода кинетических уравнений
Для вывода кинетических уравнений для скоростей по маршрутам и скоростей по веществам можно использовать три метода для стационарных и квазистационарных процессов:
Метод Боденштейна;
Условие стационарности стадий Хориути-Темкина;
Методы теории графов (для линейных механизмов).
Метод Боденштейна ![]() удобно использовать, когда мало интермедиатов и много маршрутов. Решив систему уравнений относительно Xi для тех интермедиатов, которые необходимы для определения RP в соответствии с уравнением (19), получим выражение для RP стационарного или квазистационарного процесса. Зная RP, найдем выражение для RN.
удобно использовать, когда мало интермедиатов и много маршрутов. Решив систему уравнений относительно Xi для тех интермедиатов, которые необходимы для определения RP в соответствии с уравнением (19), получим выражение для RP стационарного или квазистационарного процесса. Зная RP, найдем выражение для RN.
Условие стационарности стадий (19) дает нам систему уравнений с S неизвестными (P + NI). Метод удобно использовать, когда много интермедиатов и мало маршрутов (например, P = 1).
Пример 5. Запишем систему ![]() для примера 3 и NI = 2:
для примера 3 и NI = 2:
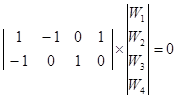
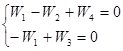
Используем веса стадий для значений Wj и доли поверхности для поверхностных концентраций, обозначив ![]() и
и ![]() .
.
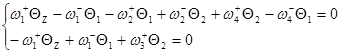
Заменим ![]() и сгруппируем неизвестные:
и сгруппируем неизвестные:
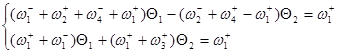
Используя метод определителей Крамера, получим ![]() и
и ![]() .
.
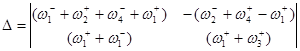
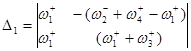
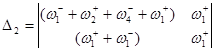
![]()
![]()
![]()
![]() (34)
(34)
Уравнение (34) является искомым уравнением скорости реакции по первому маршруту для стехиометрического базиса маршрутов (![]() ,
,![]() ) с учетом материального баланса по катализатору.
) с учетом материального баланса по катализатору.
Пример 6.
Для примера 4 запишем систему ![]() :
:
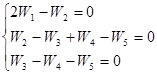
При сложении трех уравнений получим:
W1 = W5 W1 = k5[H·][C2H5·] (35)
Поскольку W3 и W4 >> W5 (условие длинных цепей)
W3 = W4+ ![]() (36)
(36)
Решая систему (25) и (26) относительно [Н·] и [С2Н5·], получим
![]() (37)
(37)
Применение условия стационарности стадий (уравнение 19) для вывода кинетических уравнений рассмотрим на примере одномаршрутного механизма гетерогенной каталитической реакции.
Пример 7.
(1) ![]()
(2) ![]()
(3) ![]()
Согласно (19):
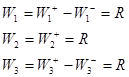
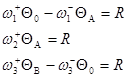
Имеем три уравнения и уравнение материального баланса ![]() , т.е. три уравнения с тремя неизвестными QA, QB и R. Заменив Q0 через 1, QA, QB, можно методом Крамера найти R.
, т.е. три уравнения с тремя неизвестными QA, QB и R. Заменив Q0 через 1, QA, QB, можно методом Крамера найти R.
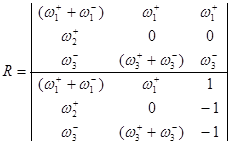
![]() (38)
(38)
Преобразуем уравнение (38):
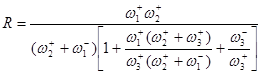 (39)
(39)
Первый сомножитель в знаменателе – следствие квазистационарности процесса, второй сомножитель есть закомплексованность катализатора (следствие учета материального баланса по катализатору). Если стадия (2) является лимитирующей стадией, то ![]() и
и ![]() . Тогда,
. Тогда,
