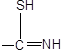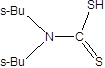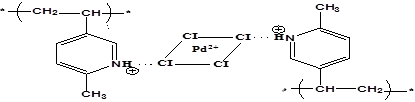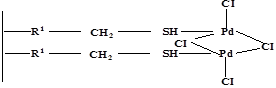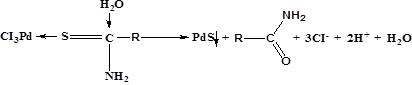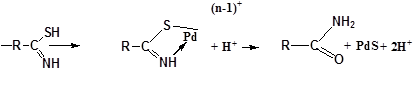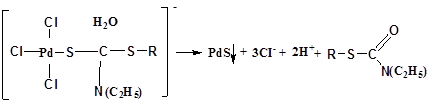Особенности сорбционного извлечения палладия (II) из хлоридных растворов волокнами ЦМ-А2, Мтилон-Т и ВАГ
Необратимое взаимодействие ПМГ по механизму внутрисферного обмена лигандов обусловлено образованием прочной связи металла с сорбентом, которая может усилиться при нагревании или высыхании насыщенного сорбента. Если комплексообразование в процессе сорбции завершится на стадии образования ониевых хлорокомплексов, то возможно элюирование с помощью кислот. Наиболее эффективнее использование раствора тиомочевины в соляной кислоте[36].
На основе литературных данных были сделаны сводные таблицы применяемых сорбционных материалов. В таблице 2 представлены основные свойства и функциональные группы волокнистых сорбентов и их кинетические характеристики, а в таблице 3 механизмы взаимодействия ионов металлов с волокнистыми сорбентами.
Таблица 2. ССЕ и тип кинетики волокнистых сорбентов
|
Название сорбента |
Функциональные группы |
ССЕ или степень извлечения |
Тип кинетики |
Литература |
|
МСПВС |
|
Из хлоридных комплексов в 2м HCI при 20°C Pd(2)-0,77 ммоль/г При 98°C Pd(2)-1,80 ммоль/г |
Смешанно-диффузионный (“гелевая” и “пленочная” диффузия) |
30,31 |
|
Мтилон-Т |
|
Из хлоридных комплексов в 1м HCI при 100°C Pd(2)-83,0 мг/г |
Смешанно-диффузионный |
28,29 |
|
Полимер стирольного типа с меркапто- группами. |
|
Из хлоридных комплексов в 1м HCI при 20°C Pd(2)-0,62 ммоль/г |
31 | |
|
Тиопан-2 Основа ПАН |
Модифиц. реагент
|
Из хлоридных комплексов в 1м HCI При 20°C Pd(2)-0,83 ммоль/г При 98°C Pd(2)-1,43 ммоль/г |
Смешанно-диффузионный |
33 |
|
Тиопан-5 Основа ПАН |
Модифиц. реагент
|
Из хлоридных комплексов в 1м HCI При 20°C Pd(2)-0,53 ммоль/г При 98°C Pd(2)-0,82 ммоль/г |
Смешанно-диффузионный |
33 |
|
Тиопан-6 Основа ПАН |
Модифиц. реагент
|
Из хлоридных комплексов в 1м HCI при 20°C Pd(2)-0,41 ммоль/г При 98°C Pd(2)-0,57 ммоль/г |
Смешанно-диффузионный |
33 |
Таблица 3. Механизм взаимодействия волокнистых сорбентов
|
Волокно |
Предполагаемый механизм сорбции |
Литература |
|
ПАН-МВП |
2RPy∙HCl+[PdCl4]2-↔(RPyH)2[PdCl4]+2Cl-
|
34 |
|
Полимер стирольно-го типа с меркапто- группами |
2R-CH2-SH+2K2[PdCl4]→[Pd(R-CH2-SH)Cl2]2+4KCl
|
31 |
|
МСПВС |
1.При рН≥7 [PdCl4]-2+H2O↔[Pd(H2O)nCl4-n]-2-n+nCl-, где n≤2 [Pd(H2O)2Cl2]+R-С(NH2)S→[Pd{R-С(NH2)S}H2OCl] 2.При рН<7 [PdCl4]-2+ R-С(NH2)S→[Pd{R-С(NH2)S}Cl3]-+Cl-
|
30,31 |
|
Мтилон-Т |
|
28,29 |
|
Тиопан-2 |
[PdCl4]-2+R-S-CS-N(C2H5)2 →[Pd{D-S-CS-N(C2H5)2}Cl3]-+Cl-
|
33 |
1.4.3 Формы нахождения палладия в растворе
Возможность выделения палладия с помощью ионного обмена напрямую связана с формами нахождения его в растворах различного состава.
Высокая склонность палладия, как и всех платиновых металлов, к комплексообразованию, приводит к тому, что палладий легко извлекается из технических растворов в виде комплексов. Рассмотрим некоторые из них.
Хлоридные комплексы палладия являются наиболее широко распространенными. Гексахлорпалладаты (![]() ) устойчивы лишь в присутствии окислителей, при нагревании разлагаются до тетрахлорпалладатов по схеме:
) устойчивы лишь в присутствии окислителей, при нагревании разлагаются до тетрахлорпалладатов по схеме:
![]()
В водных растворах хлорида палладия (2) при рН<1,0 и концентрации металла 10-6—10-2 моль/л в зависимости от концентрации хлорид-иона образуются плоскостные комплексы ![]() , состав которых и значения констант устойчивости установлены различными физико-химическими методами [37].
, состав которых и значения констант устойчивости установлены различными физико-химическими методами [37].
Кривые распределения отмечают отсутствие доминирования, каких либо комплексов, но при концентрации хлорид-иона больше 1моль/л, доминирует форма ![]() . В области концентраций хлорид-иона 0.1-0.5 моль/л сосуществуют комплексы
. В области концентраций хлорид-иона 0.1-0.5 моль/л сосуществуют комплексы ![]() и
и ![]() .
.
Таким образом, в литературе есть сообщения об изучении сорбции платиновых металлов на азот и серосодержащих волокнистых сорбентах. Однако публикаций об исследовании сорбции платиновых металлов на сорбентах, в составе которых тиоамидные и пиридиновые группы, сравнительно невелико. Поэтому исследование сорбции палладия на данных сорбентах является актуальным и этому вопросу нами уделено особое внимание.