Пиразолы, тетразолы и триазолы
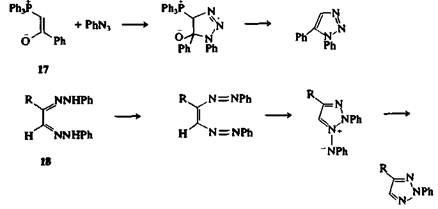
Некоторые распространенные методы получения тетразолов заключаются в присоединении азотистоводородной кислоты (Н3N) или азид-ионов к соединениям, содержащим кратную связь углерод — азот. Примерами таких реакций могут служить:
а) синтез 5-фенилтетразола нагреванием бензонитрила и азида натрия в N,N-диметилформамиде,
б) образование 1-бензилтетразола из бензилизонитрила и азотистоводородной кислоты в присутствии следовых количеств серной кислоты
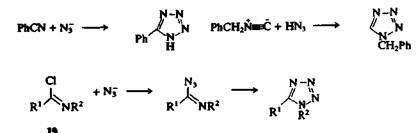
в) превращение имидоил-хлоридов 19 в 1,5-дизамещеиные тетразолы взаимодействием с НЫз или азидом натрия. 2,5-Дизамещенные тетразолы могут быть получены другим способом — реакцией амидразонов 20 с азотистой кислотой.
2.3. Свойства пиразолов
2.3.1. Реакции замещения
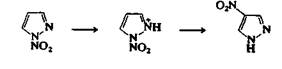
Химические свойства этих азолов отличаются от свойств пиррола тем значительнее, чем больше число атомов азота в молекуле. Для этих циклических систем относительно редки реакции злектро-фильного замещения по атому углерода, так как атомов углерода в молекуле меньше, и злектрофилы преимущественно атакуют атомы азота. Пиразолы можно хлорировать и бромировать в мягких условиях по положению 4. 4-Нитропиразол можно получить непрямым синтезом из пиразола: при взаимодействии с ацетатом нитро-ния (N02"tAc-) образуется 1-нитропиразол (21), который при обработке серной кислотой превращается в 4-нитропиразол. Эта реакция, по-видимому, протекает с переносом группы N02+ через стадию образования промежуточного катиона 22, так как было показано, что 1-нитропиразол можно использовать как удобный и эффективный нитрующий агент для ароматических углеводородов в присутствии кислот. 1,2,3-Триазол может быть превращен в 4,5-дибромопроизводное реакцией с гипобромитом натрия в уксусной кислоте, а 1,2,4-триазол можно прохлорировать по положению 3, причем реакция идет через образование 1-хлоропроизводиого, которое может быть выделено. Таким образом, для этих циклических систем возможно электрофильное замещение по атому углерода, но процесс идет через образование интермедиата, получаемого в результате первоначальной атаки электрофилом атома азота.
Азолы могут быть проалкилированы по атому азота с помощью разнообразных алкилирующих агентов, но часто бывает трудно предсказать, какой из возможных изомеров образуется. Со- отношение изомеров обычно в значительной степени зависит oт природы алкилирующего агента и условий проведения реакции. На пример, метиловый эфир 5-метилпиразол-З-карбоновой кислоть (23) метилируется диазометаном по атому N-1, а метилиодидом — по атому N-2. Иногда на образование тех или иных соединение оказывают влияние пространственные факторы: например, 4-фенил 1,2,3-триазол метилируется диметилсульфатом по атомам N-1 i N-2, а не N-3. Некоторые N-триметилсилилазолы можно про алкилировать селективно; например, 1-триметилсилил-1,2,4-триазо; (24), который легко получить из 1,2,4-триазола, алкилируется по положению 2. Триметилсилильная группа в ходе реакции отщепляется.
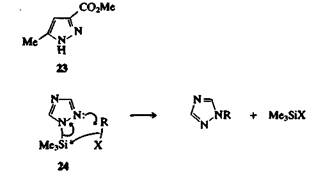
Существует много примеров кватернизации N-замещенных азолов при взаимодействии с алкилирующими агентами. Можно получить даже дичетвертичные соли: например, 1 -метил-1,2,4-триазол успешно метилируется по атомам N-4 и N-2 в избытке тетрафторобората триметилоксония, а соль 25 может быть выделена в виде твердого кристаллического вещества.
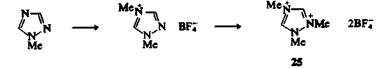
Некоторые азолы вступают в реакции нуклеофильного замещения в случае, если заместители у атомов углерода представляют собой хорошие уходящие группы. 5-Бромо- или 5-хлоро-1-замещенныететразолы могут быть превращены в другие 5-замещенные соединения взаимодействием с нуклеофилами. 1,5-Дизамещенные тетразолы реагируют легче, чем их 2,5-изомеры, вероятно, из-за того, что образующиеся интермедиаты более стабильны.
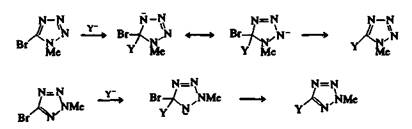
Рис. 1. Реакции нуклеофильного замещения 5-6ромо-1-метилтетразола и 5-бромо-2-метилтетразола.
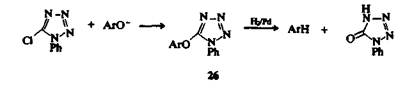
Катализируемая основаниями реакция 5-хлоро-1-фенилтетразола с фенолами приводит к образованию эфиров 26, которые могут затем подвергаться восстановительному расщеплению при взаимодействии с водородом над палладиевым катализатором, что служит хорошим методом дезоксигенировния фенолов.
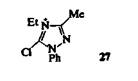
Замещение галогенов в этих азолах значительно облегчается при наличии дополнительных электроноакцепторных заместителей при атомах углерода или кватернизацией атома азота; например, в катионе триазолия 27 хлор легко замещается азид-ионами.
2.3.2. Реакции, приводящие к раскрытию цикла
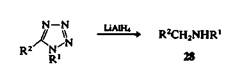
Азолы обычно с трудом подвергаются раскрытию цикла. Эти соединения устойчивы к окислительному расщеплению и не раскрываются под действием большинства восстановителей. При взаимодействии 1,5-дизамещенных тетразолов с алюмогидридом лития образуются амины 28.
Некоторые 1,2,3-триазолы и тетразолы достаточно легко раскрываются при нагревании. Кольчато-цепиая таутомерия довольно обычна для 1,5-дизамещенных 1Н-тетразолов (рис. 2, а), а также наблюдается, но реже, для 1-замещенных 1,2,3-триазолов (рис. 2, б). Раскрытие цикла облегчается наличием электроноак-цепторных групп в положении 1; например, 1-циано-1,2,3-триазол, в противоположность большинству 1,2,3-триазолов, существует в растворе в равновесии с его диазоиминной таутомерной формой.
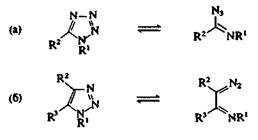
Рис. 2. Кольчато-цепная таутомерия тетразолов и 1,2,3-триазолов.
Цепные таутомеры обратимо циклизуются, но в зависимости от природы заместителей и условий реакции они могут перегруппировываться и подвергаться другим реакциям, в ходе которых происходит отщепление азота. При нагревании тетразолов и 1,2,3-триазолов, имеющих аминогруппу в положении 5, происходит перегруппировка Димрота. Эта реакция проиллюстрирована для 5-амино-1 -фенил-1,2,3-триазолов на рис. 3. Положение равновесия таких перегруппировок зависит от природы заместителей и от рН растворителя.
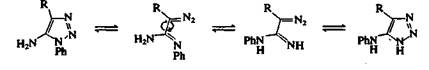
Рис. 3. Перегруппировка Димрота.
При нагревании и облучении тетразолов и 1,2,3-триазолов происходит отщепление азота. Фотолизом или термолизом 2,5-дизамещенных тетразолов получают нитрилимиды, которые затем могут вступать в реакции 1,3-диполярного циклоприсоединения или 1,5-электроциклизации в зависимости от природы заместителей. При фотолизе 1,5-дизамещенных тетразолов получают соединения, образование которых, по-видимому, идет через имидоилиитреновый интермедиат: например, 1,5-дифенилтетразол превращается в 2-фенилбензимида-зол (29). Выше был приведен другой пример синтеза имидазола.
