Поверхностно-активные вещества
Кетали
Поверхностно-активные вещества, содержащие кетальные связи, можно получить из длинноцепочечных кетонов и диолов по аналогии с реакциями, приведенными на рис. 8 и 9. Неионные расщепляющиеся ПАВ на основе длинноцепочечных карбонильных соединений, глицерина и полиэтиленоксидных цепей уже получают в промышленном масштабе. Можно исходить из длинноцепочечных кетонов или альдегидов, которые образуют соответственно кетали или ацетали в реакциях конденсации с глицерином, как уже упоминалось при обсуждении циклических ацеталей. Из кетонов прежде всего получают 4-гидроксиметил-1,3-диоксоланы, а из альдегидов — смесь 4-гидроксиметил-1,3-диоксоланов и 5-гидрокси-1,3-диоксанов. Остающуюся гидроксильную группу алкоксилируют в присутствии основного катализатора.
Кетальсодержащие ПАВ с хорошим выходом получают из эфиров кетокис-лот двумя возможными способами. Кривые биоразложения диоксо-лановых ПАВ, показанных на рис. 10, приведены на рис. Как и следовало ожидать, скорость разложения сильно зависит от длины алкильной цепи. Процесс биоразложения протекает намного быстрее для лабильных ПАВ, чем для обычных карбоксилатных ПАВ при одинаковой длине алкильной цепи. В особенности это касается соединений со структурой I, содержащей один дополнительный атом кислорода. Кетальсодержащие ПАВ, как правило, более лабильны, чем соответствующие ПАВ, содержащие ацетальные группы. Например, одинаковая степень гидролиза кетальсодержащих и ацетальсодержащих ПАВ достигается в первом случае при рН 3.5, а во втором — только при 3.0. Относительная лабильность кетальной связи обеспечена более высокой стабильностью карбокатиона, образующегося при гидролизе кеталей, по сравнению со стабильностью карбокатиона, образующегося при гидролизе ацеталей. При этом биоразложение ацетальсодержащих ПАВ протекает быстрее, чем кетальсодержащих ПАВ, если сравнивать очень близкие по структуре ПАВ. По-видимому, прямой корреляции между скоростями биоразложения и химического гидролиза не существует.
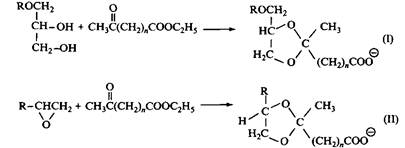
Рис. 10. Получение анионного 1,3-диоксоланового ПАВ из этиловых эфиров кетокислот
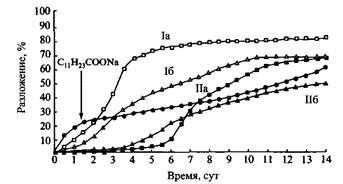
Рис. Зависимость степени биоразложения четырех кетальных ПАВ и взятого для сравнения додеканоата натрия от времени. I и II — соединения, представленные на рис. 10; а — R=Cns, з = 2; б — R=Ci6H33, з = 2
Ортоэфиры
Ортоэфиры относятся к новому классу недавно полученных поверхностно-активных веществ. Ортоэфирные ПАВ получают переэтерификацией низкомолекулярного ортоэфира, например при взаимодействии триэтилортоформиата с жирным спиртом и полиэтиленгликолем. Структуры молекул типичных ортоэфирных ПАВ и способы их получения приведены на рис. 12.
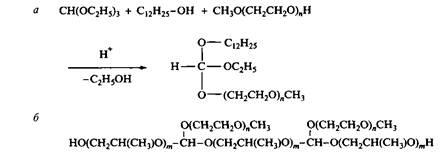
Рис. 12. Синтез и структура ортоэфирных ПАВ и ортоэфирных блок-сополимеров
Из-за трифункциональности ортоэфира получается набор веществ. Более того, если вступающий в реакцию спирт содержит две гидроксильные группы, возникают многочисленные поперечные сшивки с образованием протяженных сетчатых структур. Такие соединения являются эффективными пеногасителями. Пример такого вещества, состоящего из блоков полипропиленгликоля и ПЭГ, приведен на рис. 12. Варьированием числа и типа заместителей можно получать ортоэфирные ПАВ с заранее заданными свойствами для определенных областей применения.
Гидролиз ортоэфиров протекает по механизму, аналогичному механизму гидролиза ацеталей и кеталей. В результате гидролиза образуется один моль формиата и два моля спирта. Оба эти компонента нетоксичны. Недавно было установлено, что поверхностно-активные формиаты не оказывают нежелательных дерматологических воздействий. Тесты включали определение сенсибилизирующей емкости и раздражающего действия. При одних и тех же условиях степень кислотного гидролиза ортоэфирных ПАВ всегда выше, чем у ацеталированных ПАВ. В частности, водорастворимое ортоэфир-ное ПАВ, полученное из октанола и монометил-ПЭГ, гидролизуется на 50% в течение 2 ч при рН 5. Структура ПАВ влияет на скорость гидролиза, так что более гидрофильное ПАВ гидролизуется с более высокой скоростью.
Ортоэфирные связи можно использовать для усиления биоразлагаемости длинноцепочечных этоксилатов или блок-сополимеров. Обычный блок-сополимер ПЭГ — ППГ с молекулярной массой 2200 распадается только на 3% за 28 дней в условиях биоразложения. В то же время биоразложение соединения, построенного из блоков ПЭГ-350 и ППГ-400, соединенных орто-эфирными связями, происходит на 62% за 28 дней, и такое ПАВ можно классифицировать как легко биоразлагаемое ПАВ.
Лабильные ПAВ, гидролизующиеся в щелочной среде
Нормальные сложные эфиры четвертичных аммониевых солей
Название сложные эфиры четвертичных аммониевых солей относится к соединениям общей формулы ILN+X, в которых длинноцепочечные радикалы R присоединены к заряженной группе через сложноэфирную связь. Под нормальными эфирами ЧАС подразумеваются ПАВ, молекулы которых состоят из сложных эфиров одной или более жирной кислоты и кватернизированного ами-носпирта. На рис. 13 в качестве примеров приведены три эфира ЧАС, содержащие у атома азота по два длинноцепочечных и два короткоцепочечных заместителя. На этом рисунке приведено также исходное ПАВ — ЧАС, не содержащее лабильной связи. Видно, что молекулы таких ПАВ содержат два атома углерода между сложноэфирной связью и атомом азота, несущим положительный заряд. Гидролиз сложноэфирной связи в соединениях II-IV приводит к образованию солей жирных кислот и хорошо растворимых в воде двух- или трехатомных кватернизированных аминоспиртов. Эти продукты обнаружили низкую токсичность в тестах на рыбах. Дальше они разрушаются по установленному метаболизму. В целом по экологическим тестам сложные эфиры ЧАС гораздо лучше обычных ЧАС.
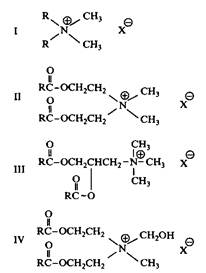
Рис. 13. Структуры обычного четвертичного аммониевого ПАВ и трех сложных эфиров ЧАС; R — длинная алкильная цепь, X — Cl, Br или CH3SO4
В последние 10-15 лет диалкилэфирные ЧАС заметно вытесняют устойчивые диалкильные ЧАС в качестве мягчителей в промывочных циклах, что составляет самую большую область применения четвертичных аммониевых соединений. Отказ от устойчивых диалкильных ЧАС и переход на использование диалкилэфирных ЧАС представляет наиболее значительное изменение типа продукта в истории ПАВ и всецело связан с защитой окружающей среды. В отличие от устойчивых ЧАС эфирные ЧАС характеризуются прекрасными показателями биоразлагаемости и токсичности в водной среде. Эти ПАВ полностью или частично вытеснили обычные ЧАС и в других областях применения катионных ПАВ, например в средствах ухода за волосами и других промышленных композициях.
Катионный заряд вблизи сложноэфирной связи делает нормальные эфиры ЧАС необычайно стабильными в кислых и лабильными в щелочных средах. Такая сильная зависимость от рН может быть использована для инициирования быстрого разложения ПАВ. Этот эффект еще больше проявляется у эфиров бетаина. Механизм их гидролиза подробно обсуждается ниже. Зависимость от рН скорости гидролиза эфиров ЧАС показана на рис. 14. Видно, что скорость гидролиза минимальна при рН 3-4 и резко увеличивается при рН выше 5-6. Понятно также, что композиции, содержащие сложные эфиры ЧАС, должны использоваться при низких рН.
