Получение молибдена из отходов промышленности
Молибденит – минерал черного цвета, внешне очень похожий на графит. Имеет чешуйчатое строение. Кристаллизуется в гексагональной слоистой решетке [20]. При нормальной температуре химически устойчив. Начинает окисляться на воздухе выше 300 – 400°С. При 500 – 550°С сгорает полностью до МоО3 и частично до МоО2. При более высокой температуре получающийся МоО3 возгоняется и, охлаждаясь, образует друзы бледно зеленоватых игл. Плотность минерала 4,75, твердость по Моосу 1. Молибденит обладает хорошими смазывающими свойствами. Постоянная примесь в нем – рений.
Повеллит – наиболее распространенный минерал зоны окисления молибденовых месторождений. Серый. Плотность 4,3, твердость по Моосу 3,5. Кристаллизуется в бипирамидах тетрагональной системы. При облучении ультрафиолетовым излучением люминесцирует. Это может использоваться в анализе и обогащении руд. Цвет люминесценции желтый. Очень хрупок и поэтому переизмельчается при дроблении.
Молибдо - шеелит – разновидность шеелита, в которой часть атомов W замещена атомами Мо (обычно не выше нескольких процентов). Разности, содержащие до 15% Мо, носят название зейригит [20, 23]. Кристаллы молибдо - шеелита, как и повеллита, - тетрагональные бипирамиды. Плотность 5,8—6,2, твердость по Моосу 4,5. Минерал, содержащий более 0,5% W, в ультрафиолетовых лучах люминесцирует желтым цветом.
Молибдит Fe2(MoO4)3∙7H2O, или Fe2O3∙xMoO3∙yH2O, - чешуйчатый, мягкий минерал серо-желтого цвета. Образуется в участках месторождений, содержащих большое количество железных минералов.
Вульфенит РЬМоО4 – минерал тетрагональной сингонии. Образует буро-коричневые или красные бипирамиды.
Другие минералы молибдена встречаются, в частности, в урановых полиметаллических месторождениях, осадочных породах органического происхождения.
Промышленные молибденовые руды делятся по форме рудных тел и минеральному составу на жильные (кварцевые), прожилково-вкрапленные (медно-молибденовые, медные порфировые, с молибденом) и скарновые (молибденовые, волъфрамо-молибденовые, медно-молибденовые). Ранее наибольшее значение имели кварцевые жильные месторождения. Среднее содержание молибдена в них было 0,3 – 0,4% и до 1 %. Они в основном выработаны. Сейчас наибольшее значение имеют молибденовые, медно-молибденовые и медно-порфировые месторождения прожилково-вкрапленного типа, а также скарновые. В первых молибдена 0,05 – 0,15%, а в наиболее крупных (Клаймакс, США) – до 0,4% [20]. Вкрапленность молибдена в них значительно более мелкая, чем в жилах. Сопутствующие рудные минералы – халькопирит, пирит, реже другие сульфиды, арсениды, магнетит. Как из медно-молибденовых, так и из медно-порфировых руд молибден добывают попутно с медью. Это экономически выгодно и в случае очень низкого содержания молибдена.
Скарновые руды – это руды, образовавшиеся на контакте известняков и кислых пород типа гранитов. Сопутствующие рудные минералы в них те же, что и в предыдущих типах руд. Но особенно обычен комплекс с шеелитом и другими вольфрамсодержащими минералами. Из нерудных минералов преобладают кварц, кальцит, флюорит. Оболочки вторичных окисленных образований осложняют обогащение сульфидной руды. Обогащение осложняется также мелкой вкрапленностью сульфидных минералов, большим содержанием кальцита, доломита, флюорита.
2.4 Электронная структура атома, его расположение в периодической системе химических элементов Д. И. Менделеева
Порядковый номер элемента в периодической системе химических элементов Д. И. Менделеева равен 42 [1, 5, 12]. Это значит, в молекуле молибдена будет 42 электрона.
Электронная формула молибдена будет такова: ![]()
Составим также его электронно-графическую формулу:
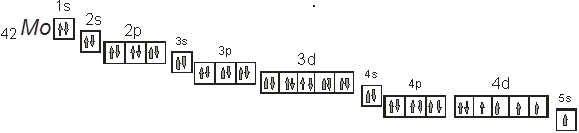
Рис. 1. Электронно-графическая формула молибдена.
На рис. 1 приведена электронно-графическая формула молибдена, на которой указано расположение всех электронов в атоме молибдена.
Порядковый номер химического элемента в периодической системе химических элементов – 42. У молибдена на электронных уровнях находится 42 электрона, а в ядре должно находится также 42 протона.
Молибден расположен в периодической системе химических элементов в пятом периоде, это значит, что у него будет пять электронных слоев с расположенными на них электронами. Главное квантовое число внешнего электронного уровня равно 5.
Молибден расположен в шестой группе, побочной подгруппе. Молибден относят к элементам подгруппы хрома, в которую входят хром, молибден и вольфрам, которые обладают похожими свойствами. У него будет на электронных уровнях один s-электрон и 5 d-электронов на предвнешнем уровне.
В состав ядра атома изотопа молибдена-96 входят 42 протона (p) и 54 нейтрона (n): ![]() , где массовое число и порядковый номер элемента (число протонов) обозначают числовыми индексами слева от символа химического элемента; верхний индекс означает массовое число, нижний – заряд ядра. Количество нейтронов ядра элементов определяют по массовому числу элемента за вычетом количества протонов.
, где массовое число и порядковый номер элемента (число протонов) обозначают числовыми индексами слева от символа химического элемента; верхний индекс означает массовое число, нижний – заряд ядра. Количество нейтронов ядра элементов определяют по массовому числу элемента за вычетом количества протонов.
Таким образом, в состав атома молибдена входят ядро, состоящее из 42 протонов, 54 нейтронов и электронное облако, представленное 42 электронами.
Вследствие устойчивости d5-конфигурации энергетически оказывается более выгодным переход одного из ns-электронов в (n-1) d-состояние. Поэтому молибден, как и хром в s-состоянии внешнего уровня имеют по одному, а в предпоследнем слое по 13 электронов. Таким образом, имеет место «проскок» электрона:
![]()
Проскок электрона можно объяснить с точки зрения квантово-механических представлений повышенной энергетической стабильностью конфигурации: 4d5 [1, 5].
Покажем расположение валентных электронов в атоме молибдена. Как видно из электронной формулы молибден относится к d-элементам, поскольку у него заполняется 4d-подуровень.
![]()
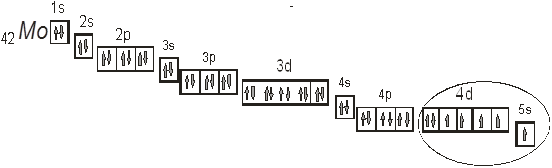
Рис. 2. Расположение валентных электронов в атоме молибдена.
На приведенном рис. 2 эллипсом выделено расположение валентных электронов в атоме молибдена. Как видно в создании химической связи будут брать участие электроны как 5s- так и 4d-подуровня.
Поскольку молибден расположен в шестой группе периодической системы, и не в главной подгруппе, а в побочной, то он относится к металлам. В химических реакциях он будет проявлять металлические свойства. Для металлов более приемлема отдача электронов. Поэтому молибден может отдавать максимум шесть электронов с ![]() - подуровня и с 4d-подуровня. Поэтому молибден будет проявлять степень окисления +2, +3, +4, +5, +6. соединения с этими степенями окисления обладают разной стойкостью, наиболее стойкими будут соединения с степенью окисления равной +6 [1].
- подуровня и с 4d-подуровня. Поэтому молибден будет проявлять степень окисления +2, +3, +4, +5, +6. соединения с этими степенями окисления обладают разной стойкостью, наиболее стойкими будут соединения с степенью окисления равной +6 [1].
