Получение молибдена из отходов промышленности
3.2 Получение парамолибдата аммония (NH4)6Mo7O24 × 4H2O
Химическую переработку «огарков» после обжига богатых высококачественных концентратов производят с целью получения чистых соединений молибдена – парамолибдата аммония и молибденового ангидрида [20, 23]. Из этих последних в случае необходимости легко получить любые другие соединения, в том числе и соединения высокой чистоты. Молибденовый ангидрид, находящийся в огарке, растворяется в растворах аммиака, щелочей, соды, некоторых кислот. Но щелочные металлы – нежелательные примеси для соединений молибдена, применяемых в электротехнической и химической промышленности. В щелочах, соде и кислотах растворяется большое число и других примесей.
Раствор аммиака обладает тем преимуществом, что в нем не растворимо большинство примесей, сопутствующих молибдену в огарке. Поэтому аммиачный способ переработки богатых молибденовых огарков более распространен. Его преимуществами, помимо высокого извлечения МоО3 в раствор и достаточно полного отделения примесей, являются простота дальнейшей очистки аммиачного раствора, легкость выделения молибдена в виде чистого парамолибдата аммония, простота подбора материала для аппаратуры. Схема аммиачного метода переработки огарков после обжига молибденита представлена на рис.3
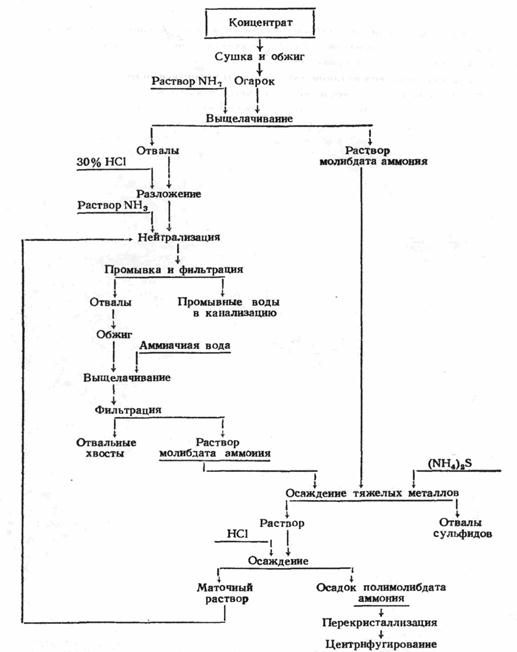
Рис. 3. Cхема переработки огарков с кислотным разложение хвостов выщелачивания
Перед обработкой раствором аммиака рекомендуется промывать огарок водой для удаления растворимых в воде сульфатов (CuSO4, части CaSO4 и др.) и солей щелочных металлов. Но так как при этом несколько теряется молибден, то промывают не всегда. Потеря молибдена при промывке достигает 4 – 5% [20].
При обработке огарка аммиаком происходят реакции:
MoO2 + 2NH4OH = (NH4 )2МоО3 +H2О
CuO + 4NH4OH = [Cu(NH3)4](OH)2 + 3H2O
CuMoO4 + 6NH4OH = [Cu (NH3)4] (OH)2 + (NH4)2 MoO4 + 4H2О
ZnMoO4 + 6NH4OH = (NH4)2 MoO4 + [Zn (NH3)4] (OH)2 + 4H2O NiMoO4 + 6NH4OH = (NH4)2 MoO4 + [Ni (NH3)4] (0H)2 + 4H2O
Аналогично молибдатам реагируют сульфаты меди, цинка, никеля и железа, если они образовались при обжиге. Железо (II) (в составе сульфата или окиси) частично реагирует по уравнению
FeSO4 + 4NH4OH → [Fe (NH3)4] SO4 + 4H2О
и переходит в раствор в составе комплекса. Железо (III), образующееся в результате окисления Fe2+ кислородом воздуха при обжиге и выщелачивании, частично остается в составе химически стойкого Fe3O4, частично дает нерастворимую гидроокись Fe(OH)3.
Остаются без изменения МоО2, СаМоО4, кварц, неокислившиеся при обжиге сульфиды. В аммиачные растворы в зависимости от минералогического состава концентрата и условий обжига переходит 80 – 95% молибдена. Для более полного перевода молибдена в раствор добавляют 60 – 80 кг (NH4)2CO3 на 1 т огарка. Влияние карбоната аммония на извлечение молибдена связано со следующими реакциями:
CaSО4 + (NH4)2 MoO4 → CaMoO4 + (NH4)2 SO4
CaSО4 + (NH4)2 CO3 → Ca CO3 + (NH4)2 SO4
Растворимость CaSO4 и СаМоО4 соответственно 2 и 0,028 г/л при 20°С. Поэтому реакция смещена в сторону образования СаМоО4. Без добавки (NH4)2CO3 в процессе выщелачивания раствором аммиака сульфат кальция, образовавшийся в огарке в ходе обжига, превращается в СаМоО4, устойчивый в аммиачных растворах. Добавка (NH4)2CO3 ведет к образованию СаСО3 из CaSO4. Возможно и частичное растворение СаМоО4:
СаМоО4 + (NH4)2 CO3 = (NH4)2 МоО4 + СаСО3
Осаждение СаСО3 на частицах CaSO4 затрудняет растворение последнего [20]. Осаждение его же на зернах СаМоO4 прекращает растворение последнего. Кроме того, благодаря наличию ионов СО![]() в растворе в отвальные хвосты переходит не гидроокись железа, а карбонат, который меньше адсорбирует молибден. Это снижает переход молибдена в остатки от выщелачивания. Сухой остаток после выщелачивания и сушки составляет 10 – 30% от массы огарков. В нем 5 – 25% Мо. Поэтому на заводах дополнительно обрабатывают остаток по особой схеме.
в растворе в отвальные хвосты переходит не гидроокись железа, а карбонат, который меньше адсорбирует молибден. Это снижает переход молибдена в остатки от выщелачивания. Сухой остаток после выщелачивания и сушки составляет 10 – 30% от массы огарков. В нем 5 – 25% Мо. Поэтому на заводах дополнительно обрабатывают остаток по особой схеме.
В заводских условиях огарок выщелачивают 8 – 10%-ным раствором аммиака при 20 – 60° С [23]. Процесс проводят во вращающихся горизонтальных герметических стальных барабанах с шарами или в вертикальных реакторах с мешалками. Вращающиеся герметические барабаны более экономичный по извлечению молибдена, и по расходу аммиака процесс. Процесс в обоих случаях периодический и идет в несколько стадий, хотя в принципе возможна организация непрерывного или полунепрерывного выщелачивания в каскадах герметизированных реакторов. Раствор с первых стадий поступает на очистку и дальнейшее извлечение молибдена. Слабые растворы и промывные воды поступают на первую стадию. Общий расход аммиака на всех стадиях в зависимости от состава концентрата и аппаратуры колеблется в пределах 115 – 140% от теоретически необходимого количества. В крепких растворов плотность более 1,1 г/см3,они содержат 140 – 190 г/л МоО3. Остатки от выщелачивания отфильтровывают на фильтрах непрерывного или периодического действия [8].
В последнее время предложено выщелачивать огарки аммиаком в кипящем слое. Это интенсифицирует выщелачивание и может осуществляться в непрерывном процессе.
Концентрированные растворы после фильтрования очищают от тяжелых металлов, осаждая их в виде сульфидов:
Me2++NH4HS = MeS + NH4+ + H+
где Ме2+ - Cu2+, Pb2+.
Fe2+ частично осаждается в виде FeS, частично захватывается осадком других сульфидов. Благодаря очень малому произведению растворимости сульфидов, все тяжелые металлы осаждаются практически полностью. Это, в частности, можно наглядно наблюдать по исчезновению характерной интенсивной сине-фиолетовой окраски раствора. характерной для медно-аммиачного комплекса
Из очищенного аммиачного раствора молибден может быть выделен:
1) кристаллизацией парамолибдата аммония;
2) осаждением тетрамолибдата;
3) осаждением молибденовой кислоты;
4) осаждением СаМоО4:
7(NH4)2МоО4 =3(NH4)2О• 7МоО8 ∙ 4Н2О + 8NH3
4 (NH4)2 MoO4 + 5H2O = (NH4)2О ∙ 4MoO3 ∙ 2H2O + 6NH4OH (NH4)2 МоO4 + 2HNO3 = Н2МоО4 + 2NH4NO3
(NH4)2 MoO4 + СаС12 = CaMoO4 + 2NH4C1
Кристаллизацию парамолибдата производят в несколько стадий. После первых стадий получается наиболее чистый продукт, но с небольшим выходом. Увеличения выхода достигают дальнейшей, более глубокой кристаллизацией, но при этом продукт получается более низкого качества. Молибденовая кислота частично растворима в кислотах и выделяется в виде трудно отстаивающихся и трудно промываемых осадков. Осаждение тетрамолибдата дает высокое извлечение молибдена и богатый молибденом продукт. Осадок его лучше отстаивается, но продукт требует переочистки. Осаждение СаМоО4 из аммиачных растворов нерационально, так как он применяется лишь при выплавке ферромолибдена и может быть получен более простым путем. Для других же целей требовалась бы дальнейшая химическая переработка СаМоО4. Введение иона Са2+ усложняло бы дальнейшую очистку соединений молибдена.
