Получение пурпуреосоли. Аммиакаты кобальта (III)
Наличие изомерии у рассмотренных выше соединений показывает, что самое явление не зависит ни от природы кислотных остатков, ни от природы нейтральных молекул. Природа составных частой комплекса определяет свойства изомеров, их устойчивость в водном растворе, возможность их взаимной превращаемости, но наличие самого факта изомерии не зависит от природы заместителей.
Можно представить себе такой случай, когда неустойчивость комплекса настолько велика, что одна из изомерных форм может не поддаваться изолированию, но совокупность имеющегося экспериментального материала заставляет смотреть на подобные случаи как на исключение, обусловленное именно неустойчивостью соединения. Высказанное положение подтверждается далее тем, что изомерия отнюдь не ограничивается производными трехвалентного кобальта, но наблюдается также на соединениях других металлов, относящихся к диацидотетраминовому типу.
Кроме производных Со(Ш) известны соли диацидотетраминового типа, образующиеся от Сr(III), Rh (III), Ir(III) и Pt(IV).
Механизм замещения реакций комплексов кобальта (III)
Поскольку рассмотрение реакций лабильных комплексов не дало возможности четко определить вероятный механизм реакции, необходимо рассмотреть более медленно реагирующие системы. Как и следовало ожидать, наибольшее количество кинетических исследований проведено для инертных комплексов Со(Ш), Сг(1П) и некоторых соседних с ними элементов. Так как Со(Ш) образует самые разнообразные комплексы, то естественно ожидать, что в этом случае можно получить наиболее полные сведения о тонком механизме реакции Реакции замещения можно для удобства разделить на несколько категорий и рассмотреть каждую из них.
Кислотный гидролиз
Кинетическими методами наиболее интенсивно изучалась реакция замещения, которую обычно называют реакцией аквотации, например
МА5Хn+ Н20 = MA5H2On+1 + X-
Аналогично часто термином "гидролиз" называют реакцию
МА5Хn+ ОН- = МА5ОНn + Х-.
Так как обе эти реакции по существу являются реакциями комплексного иона с водой, то было предложено называть их реакциями гидролиза. Если продуктом реакции является акво-комплекс, то реакцию называют реакцией кислотного гидролиза, а если продуктом реакции является гидроксо-комплекс, то реакцию называют реакцией основного гидролиза.
В зависимости от рН раствора и кислотно-основных свойств аква-комплекса очевидно, что продуктами реакции могут быть одновременно акво-и гидроксокомплексы в соизмеримых количествах.
В таком случае реакцию просто называют реакцией гидролиза, не указывая специально, происходит ли кислотный или основной гидролиз. Такая терминология будет использоваться в настоящей книге, так как считают, что в ней заложено больше информации, чем в более старых терминах аквотация и гидролиз.
По скоростям кислотного гидролиза имеется большое количество данных. Для водных растворов установлено, что кинетика соответствует реакции первого порядка. Этого результата следовало ожидать, так как концентрация реагирующего вещества и растворителя не изменяется во время реакции. Поэтому скорость реакции зависит только от концентрации комплекса, и реакция является реакцией первого или псевдопервого порядка. Этот факт сам по себе не дает какой-либо информации относительно роли молекул воды и о молекулярном механизме этих реакций.
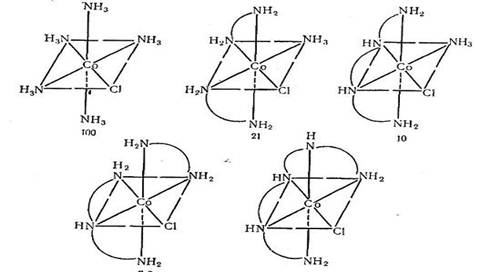
Тем не менее можно ожидать, что зависимость констант скорости реакций от природы комплекса даст некоторую информацию о механизме реакции. В табл. 3 приведены данные по кислотному гидролизу ряда хлороамминов Со(Ш). Эти данные позволяют сделать два вывода: 1) увеличение числа циклов в комплексе, как, например, при замещении двух NH3-rpyпп на молекулу этилендиамина, заметно уменьшает скорость кислотного гидролиза; 2) моно-хлоро-комплекеы металлов с зарядом два реагируют примерно в 100 раз медленнее, чем дихлоро-комплекс с зарядом плюс один. Это также подтверждается тем фактом, что кислотный гидролиз таких комплексов происходит в две ступени:
Со(АА)2С12+ + Н20 = Со(АА)2(Н20)С12+ + С1- "а"
Со(АА)2(Н20)С12+ + Н20 -> Со(АА)2(Н20)Г + С1- "б"
Вторая реакция протекает примерно в 100 раз медленнее, чем первая.В табл. 3 приведены константы скорости для реакций типа "а".
Объяснение влияния положительного заряда комплекса на скорости реакции очевидно. Удаление отрицательного заряда (ион С1-) из комплекса тем более трудно, чем выше получающийся в результате этого заряд комплекса. Это прямо указывает на существенную роль разрывающейся связи и на то, что в любом случае механизм SN2(lim) отсутствует. Если реакции происходят по диссоциативным механизмам, то реагентом является молекула воды и взаимодействие заряженного комплекса с диполем молекулы воды будет меньше, чем с электрическим зарядом хлорид-иона. Следовательно, процесс 8к2 нельзя исключить, хотя, как установлено, относительный порядок "разрывающейся связи более важен, чем порядок образующейся связи".
Интерпретация влияния числа циклов в комплексе на скорость реакции менее ясна. Конечно, возможно, что механизм диссоциации, действующий с противоположной по отношению к замещаемому галогенид-иону стороны комплекса, будет затруднен.
На рис. показано влияние числа циклов на относительную скорость реакции. Действительно, для комплексов Co(en)(dien)Cl2+ и Co(tetraen)Cl2t кажется, что такой механизм невозможен. Тот факт, что эти комплексы реагируют лишь немного медленнее, чем другие комплексы этого ряда, указывает на невозможность механизма SN2 с транс-атакой.
Очевидно, решающее влияние на скорость реакции оказывает индуктивный эффект циклического амина по сравнению с NH3. Константы кислотной диссоциации монопротонированных ониевых ионов следующие: NH* 9,28; епН+ 9,93; dienH* 9,98; trienH+ 9,92 [55]. Таким образом, NH3 —(несколько более слабое основание и, следовательно, не отдает полностью свою электронную пару иону Со(Ш). Но если это правильно, то хлорид-ион должен был бы удерживаться \более прочно положительным зарядом иона кобальта и реакция должна была бы быть медленной. Однако экспериментально наблюдается прямо противоположное.
Это можно объяснить на основании других аргументов, использующих электростатическую теорию. Когда ион С1- уходит из исходного комплекса, то необходима дополнительная сольватация молекулами воды, создающими вторую координационную сферу. Это означает, что трехзарядный катион сольватируется более интенсивно, чем двухзарядный. Из уравнения Борна видно, что энергия сольватации тем больше, чем меньше размер иона. Одним из последствий замещения молекул NH3 на полиамины является, конечно, увеличение размера комплекса. Чем больше ион, тем меньшей будет энергия сольватации и тем труднее он образуется. Эти аргументы справедливы также для переходного состояния, в котором хлорид-ион только частично удален.
