Принцип полярографического метода
Как вытекает из самого названия, полярография основана на явлении поляризации электродов при прохождении электрического тока через проводники второго рода (растворы электролитов). Поляризация электродов обусловлена замедленностью электродных процессов. Она складывается в основном из трех видов: электрохимической, концентрационной и омической. Для уяснения сущности электрохимической поляризации рассмотрим следующий опыт.
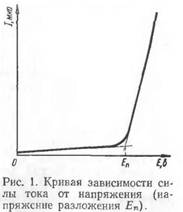
Предположим, что взят водный раствор СиС12, в который опущены два платиновых электрода, присоединенные к источнику постоянного электрического тока. Через раствор проходит электрический ток, в результате чего на катоде выделяется медь (Си2+-{-2е—*Си), а на аноде — хлор (2С1~—2е—>-С12). Таким образом, в результате электролиза образуется новый гальванический элемент из двух новых электродов (Cu/Cu2+ и С12/2С1_), электродвижущая сила которого направлена против приложенного извне напряжения. В связи с этим сила тока в цепи будет падать, практически приближаясь к нулю. Если напряжение внешней цепи повысить, то сила тока в цепи вновь возрастает, но по мере дальнейшего выделения продуктов электролиза на электродах она снова будет уменьшаться. При повторном повышении напряжения такая закономерность будет повторяться до тех пор, пока величина напряжения, приложенного извне, не будет достигать электродвижущей силы вновь образовавшегося гальванического элемента и на бесконечно малую величину превышать эту силу. После этого сила тока в цепи будет непрерывно расти с повышением напряжения. Кривая зависимости силы тока от приложенного напряжения в такой «цепи приведена на рис. 1.
Если (провести касательную от скачкообразно возрастающей части кривой силы тока / до оси абсцисс Е, то найдем значение электродвижущей силы (э.д.с.) гальванического элемента, который образовался вследствие электролиза. Эта э.д.с, как уже было указано выше, направлена против приложенного напряжения и называется электродвижущей силой поляризации.
В существовании ее нетрудно убедиться, если, выключив во время электролиза источник тока, присоединить проводником электроды к клеммам гальванометра! При этом стрелка гальванометра отклонится в сторону! противоположную той, в которую она отклонялась пол влиянием внешней э. д. с. при электролизе.
То наименьшее напряжение, которое необходимо приложить к электродам для того, чтобы вызвать непрерывный электролиз данного электролита, называется напряжением разложения. Оно должно быть больше, чем э.д.с. электрохимической поляризации.
Причиной поляризации может являться не только возникновение нового гальванического элемента вследствие выделения на электродах продуктов электролиза, но и изменение концентрации ионов в приэлектродном пространстве.
Например, при электролизе раствора CuS04 с медными электродами на аноде медь будет растворяться, а на' катоде осаждаться.
Поэтому в процессе электролиза, несмотря на диффузию ионов в растворе из более концентрированных областей в более разбавленные, концентрация ионов меди у анода несколько увеличится, а у катода уменьшится, и в результате возникнет концентрационный гальванический элемент, э.д.с. которого также направлена против приложенного напряжения (концентрационная поляризация).
Сдвиг потенциала (по сравнению с его равновесным значением при отсутствии тока), происходящий вследствие изменения концентрации потенциалопределяющих ионов у электродов в процессе электролиза, характеризует величину концентрационной поляризации.
Омическая поляризация обусловлена образованием на поверхности электрода тонкой пленки, состоящей из оксидов, гидроксидов металлов или адсорбированных молекул органических веществ (при исследовании растворов органических соединений).
Величина омической поляризации равна RI, где R — электросопротивление пленки, a t — сила тока.
Полярографический метод основан на определении зависимости силы тока от потенциала при электролизе) раствора исследуемого вещества в определенных условиях, в специальном электролизере.
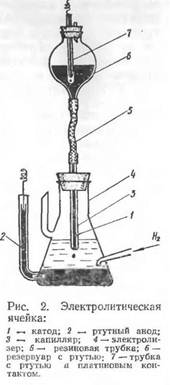
Основная часть полярографа представляет собой электролитическую ячейку, состоящую из сосуда, наполненного раствором анализируемого вещества, и двух ртутных электродов (рис. 2). Анодом является ртуть, заполняющая дно сосуда; катодом — капли ртути образующиеся на конце капиллярной трубки, заполненной ртутью. Под влиянием собственной тяжести капля ртути падает на дно сосуда, после чего образуется новая капля и т.д. Таким образом, катодом является непрерывно возобновляющаяся капля ртути.
При прохождении через раствор даже небольшой силы тока (106 а) благодаря малой поверхности, а следовательно, большой плотности тока на ртутной капле, происходит химическая поляризация катода за счет восстановления ионов или молекул исследуемого вещества на поверхности электрода. В результате электрохимического восстановления на поверхности ртутной капли образуется вещество, при этом потенциал катода ек определяется соотношением концентраций исходного и восстановленного вещества и является характерным для данной реакции.
Так как площадь ртутного анода большая, а плотность тока на нем мала, то химические явления не способны изменить электродный потенциал анода еа, поэтому потенциал анода практически сохраняется неизменным.
Таким образом, при прохождении тока через описанную ячейку, когда протекает непрерывный электролиз, возникает электродвижущая сила поляризации, равная £п = еа — ек, направленная навстречу приложенному напряжению Е. Если учесть омическое сопротивление, то сила тока по закону Ома равна:
![]()
отсюда![]()
где R — сопротивление раствора между электродами. Поскольку сопротивление Я раствора обычно не превышает 100 ом, то произведение IR очень мало (Ю-6 -100= =0,1 мв); в таком случае можно считать, что IR^O, следовательно:![]()
Принимая постоянный потенциал анода условно за нуль, получим выражение:![]()
показывающее, что все приложенное напряжение Е уравновешивается потенциалом поляризации катода. Поэтому такой ртутный электрод называют абсолютно поляризующим. Потенциал его зависит от природы восстанавливающегося на нем иона или вещества.
Зависимость «сила тока — потенциал» выражается обычно графически в виде поляризационных кривых (полярограмм). Величины потенциалов в вольтах (или милливольтах) откладываются на оси абсцисс, а соответст-
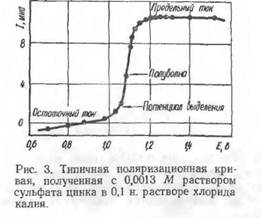
вуюшие им силы тока в микроамперах — на оси ординат. Общий.вид типичной поляризационной кривой приведен на рис. 3. Так как ртутные капли сменяют друг друга через определенный промежуток времени, то по-лярограммы имеют обычно зубчатый вид, поскольку в момент отрыва капли ток прерывается. Сопротивление раствора должно быть возможно меньшим (<С 1000 ом), поэтому для увеличения электропроводности вводят в раствор добавки электролитов, не вступающих в реакцию с испытуемым раствором и не выделяющихся на электроде при потенциалах восстановления исследуемых веществ. Такие добавки называют фонами (КС1, LiCl, Na2S04, NH4CI, тетраалкиламмониевые соли и др.).
