Производство окислов урана
Окислы урана — двуокись, закись-окись и трехокись — представляют важнейшие в технологическом отношении соединения урана. Двуокись применяется для изготовления тепловыделяющих элементов ядерных реакторов.
Огнеупорность двуокиси урана, устойчивость к действию радиации и относительная инертность являются главными факторами, обуславливающими ее применение как ядерного горючего. Применение обогащенной изотопом урана-235 двуокиси в виде зерен в металлических или керамических матрицах позволяет создавать тепловыделяющие элементы, способные работать при высоких температурах в реакторах с большим удельным теплосъемом. Основным недостатком двуокиси урана является низкая теплопроводность, которая ограничивает величину изделий.
Двуокись урана имеет важное значение как промежуточный продукт при производстве тетрафторида и далее гексафторида урана. Достоинство двуокиси урана в данном случае перед другими окислами заключается в том, что в этом соединении уран четырехвалентен; как в теграфториде, в связи с чем не требуется дополнительных операции по его восстановлению. Двуокись урана совместно с закисью-окисью может использоваться в качестве исходного продукта и производстве металлического урана. Шихта в этом случае готовится из окислов урана, металлического кальция и флюсующих добавок (например, хлорида кальция). После восстановления порошкообразный уран отмывают от примесей, прессуют и обжигают при высоких температурах до компактного металла или переплавляют.
Технологическое значение других окислов урана — закиси-окиси и трехокиси несколько меньше. Эти соединения не применяются в качестве ядерного горючего, но служат промежуточными продуктами в производстве двуокиси тетрафторида, гексафторида и металлического урана.
Кроме того, благодаря высокой стабильности при обычных условиях закись-окись и трехокись урана могут использоваться для целей хранения.
К окислам урана в соответствии с указанными областями их применения предъявляют определенные требования, связанные прежде всего с их чистотой. При самостоятельном использовании двуокиси урана в ядерных реакторах содержание примесей в ней должно соответствовать требованию ядерной чистоты.
Если окислы используются для производства тетрафторида или других соединений урана, требования по чистоте могут быть несколько иными. В частности, содержание примесей определяется методом получения
тетрафторида; таи, при получении тетрафторида урана из водных растворов достигается хорошая очистка от примесей, в то время как при сухом процессе возможно даже загрязнение урана продуктами коррозии. Поэтому в зависимости от принятого метода получения тетрафторида окислы урана могут содержать большее или меньшее количество примесей.
Далее тетрафторид, полученный из окислов, можно перерабатывать либо до металла, либо до гексафторида. В первом случае тетрафорид должен быть ядерночистым и даже несколько чище на случай возможного загрязнения урана при плавке. Во втором достигается хорошая очистка урока от примесей нелетучих фторидов, в связи с чем к исходному тетрафториду, а следовательно, и к окислам предъявляются менее .жесткие требования но содержанию примесей.
Особенно большое значение имеют физические свойства окислов урана: насыпной вес, размер кристаллов и агрегатов, пористость и т. д.
Изделия из двуокиси урана, используемые в качестве тепловыделяющих элементов, должны обладать высокой плотностью, близкой к теоретической (10,96 г/см3). Изделия такой высокой плотности можно получить лишь из определенных порошков двуокиси урана. Пригодность двуокиси для последующего прессования и спекания в изделия обусловливается способом ее получения.
Как видно из этих данных, более удобен для получения двуокиси керамического сорта метод термического разложения с одновременным восстановлением диураната аммония. Образцы плотностью выше 10 г/см9 можно получить и из худшего по спекаемости порошка, но тогда потребуются более высокие давления прессования и большее время спекания. Размер кристаллов двуокиси керамического сорта колеблется
в пределах десятых долей микрона.
Если окислы урана используются в качестве промежуточных продуктов в производство тетрафторида и других соединении урана, их физические свойства в существенной степени определяют эффективность операций восстановления и фторирования. Реакционная способность окислов урана зависит от метода их получения, в частности наиболее активные образцы получаются разложением солей при низкой температуре; при осуществлении тех же операций при более высокой температуре реакционная активность окислов снижается,
Однако не только температура, но и вид исходного соединения урана влияет на физические свойства полученных из него окислов. Например, наиболее крупные кристаллы трехокиси получаются при разложении нитрата уранила. наиболее мелкие при термической диссоциации пероксида урана. В то же время размер агрегатов трехокиси урана, Получающейся из нитрата уранила, меньше, чем полученной из пероксида урана.
От физических свойств трехокиси: урана зависят как скорость и эффективность последующего процесса се восстановления, так и в значительной мере физические свойства образующейся при этом двуокиси. Трехокись, полученная из диурапата аммония, восстанавливается водородом быстрее, чем изготовленная из нитрата уранила. Это вызвано, по-видимому, различием в условиях фазового контакта твердого вещества и газа.
В общем случае, чем более крупнокристаллической является трехокись урана, тем больше размер кристаллов получаемой из нее двуокиси;
повышение температуры восстановления обычно приводит к увеличению
размера частиц и к уменьшению
удельной поверхности порошка.
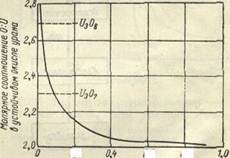
Рисунок 1 – Влияние размера частиц на соотношение кислорода и урана
Скорость гидрофторирования двуокиси урана фтористым водородом зависит прежде всего от ее реакционной способности, от размера кристаллов и агрегатов. Двуокись урана, полученная из диураната аммония, состоит из больших агрегатов сравнительно мелких частиц и обладает высокой удельной поверхностью. В связи с этим скорость гидрофторировании подобных образцов довольно значительна даже при низкой температуре; повышение температуры приводит к закупориванию пор агрегатов в результате спекания образовавшегося тстрафторида урана.
Двуокись урана, полученная из уранилнитрата, менее склонна к образованию агрегатов, но размер кристаллов ее довольно велик; поэтому реакционная способность двуокиси урана, приготовленной из уранилнитрата, ниже.
Примерно такие же закономерности характерны и для процесса окисления двуокиси урана кислородом воздуха. Двуокись с размером частиц порядка сотых долен микрона и ниже пирофорна уже при 0°; интенсивное окисление двуокиси урана с размером частиц 0.4 мк протекает при 150°. При обычной температуре окисление двуокиси, как правило, не приводит к образованию стехиометрических соединений закиси-окиси или трехокиси урана; состав полученных продуктов сильно меняется, причем степень этого изменении и степень окисления двуокиси урана всецело определяются размером частиц (рис. 1).
