Производство окислов урана
Для любой другой температуры эти кривые сдвигаются в область более высоких соотношений кислорода и урана.
ПОЛУЧЕНИЕ ВЫСШИХ ОКИСЛОВ УРАНА ИЗ СОЛЕЙ УРАНИЛА
В подавляющем большинстве случаев технологические операции по получению окислов урана проводятся поело аффинажа урана. Так как наиболее распространенным методом очистки служит экстракционно реэкстракционный процесс с применением трибутилфосфата, в конечном итоге получаются растворы уранилнитрата, очищенные от примесей других элементов. Непосредственная переработка этих растворов в окислы является наиболее технологически оправданным приемом. Иногда уран целесообразно выделять из азотнокислых растворов в виде осадков диурапата или пероксида и только лишь после фильтрации и промывки прокаливать их до окислов урана. Во всех этих случаях соединения урана прокаливают на воздухе; в результате получаются высшие окислы урана: трехокись (при температуре прокаливания 400—450° С) и закись-окись (при более высокой температуре). Полученные
в этих процессах высшие окислы урана можно восстанавливать водородом или аммиаком до двуокиси .
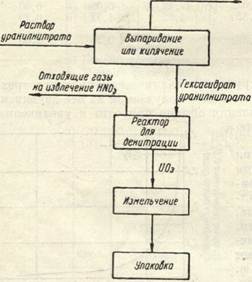
рисунок 2 - Получение окислов из уранилнитрата
Технологическая схема получения трехокиси урана из растворов уранилнитрата состоит из двух основных операций (рис. 2); а) выпаривание растворов уранилнитрата до концентрации б) дальнейшее прокаливание происходит дополнительная при котором и денитрация с образованием трехокиси гексагидрата дегидратация и денитрация с образованием трехокиси.
UO2(NO3)2*xH2O à UO3+NO+NO2+O2+xH2O
Шестиводный и трехводный гидраты уранилнитрата плавятся инконгруэнтно соответственно при 60 и 113 градусах. Система уранилнитрат — вода стабильна до точки плавления дигидрата 184°. Выше 184 происходит разложение на трехокись урана и окислы азота. Первое превращение шестигидрата уранилнитрата при термическом разложении идет до тригидрата по реакции
по реакции
UO2(NO3)2*6H2O à UO2(NO3)2*3H2O+3H2O
Превращение тригидрата в дигидрат идет по реакции
UO2(NO3)2*3H2O à UO2(NO3)2*2H2O+H2O
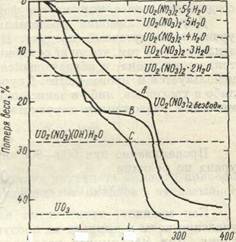
Рисунок 3 – Термогравиметрические кривые разложения гексагидрата уранилнитрата
Ход разложения у ран ил нитрата при непрерывном повышений температуры зависит от того, проводится ли оно на воздухе или в вакууме (рис. 3). Денитрация в вакууме протекает быстрее, чей при атмосферном давлении. Скорость нагрева также влияет на форму термогравиметрической кривой. При меньших скоростях нагрева уранилнитрат разлагается при более низкой температуре. Несмотря на различие процессов разложения при низких температурах на воздухе и в вакууме, температура диссоциации UO2(NO3)2 во всех случаях почти одинакова. Оптимальной температурой разложения уранилнитрата до трсхокисии считается 400°, так как выше 430° трехокись урана начинает отщеплять кислород. Кроме того, при низкой температуре получается более реакционноспособная трехокись урана, легко превращаемая в двуокись и тетрафторид; поэтому процесс термической диссоциации урацилиитрата приводят при температурах, не превышающих 400—4500.
Полученная в промышленных условиях трехокись урана обычно содержит 0.04 - 0,1% азота, концентрацию которого в результате повторной гидратации и дегидратации снижают до 0.001%.
250 H20
UO3+2H2O <==> UO3*2H2O
Физические свойства трехокиси урана зависят от температуры прокаливании и скорости подъема температуры. При медленном нагревании гексагидрата уранилнитрата до 350— 4000 образуется трехокись урана, имеющая насыпной вес 2.8 г/см3, при быстром — 4,2 г/см3. Первый из образцов обладает значительно большей реакционной способностью, чем второй (если термическую диссоциацию уранилнитрата проводить в токе аммиака, то насыпной вес окислов урана уменьшается до 1,5—1,8 г/см3). Размер кристаллов трехокиси урана колеблется в пределах около 1 мк.
Разлагают уранилнитрат в аппаратах периодического и непрерывного действия. В стадии разработки находятся печи кипящего слоя.
ПОЛУЧЕНИЕ ОКИСЛОВ ИЗ ДИУРАНИТА АММОНИЯ
При действии на соли уранила аммиака выделяется осадок переменного состава, которому обычно приписывают состав диураната аммония. Фактически же при обычном режиме осаждения состав получаемого соединения точнее выражается формулой (NН4)2U4013
Диуранат аммония представляет распространенный в технологии урана промежуточный продукт. Ценность его для получения окислов заключается в том, что он не содержит в своем составе нелетучих компонентов, кроме урана, а образующийся при прокаливании аммиак повторно используется в производстве. Диуранат аммония может быть переведен либо в трехокись, либо в лакись-окись урана. Трехокись получается термическим разложением диураната на воздухе при 250—400°
(NH4)2U2O7 à 2UO3+2NH3+H2O
Прокаливание при 600—900° приводит к образованию закиси-окиси урана по реакции
9(NH4)2U2O7 à 6U3H8+14NH3+15H2O+2N2
Как правило, прокаливают пляжный диуранат аммония. Степень удаления воды и аммиака из продукта зависит от температуры прокаливания. При 400° аммиак удаляется практически полностью, воды удаляется большая часть; при 600° происходит полное удаление аммиака и воды, однако в этих условиях уже начинается разложение трехокиси на закись-окись урана и кислород (табл. 1)
Таблица 1 - Влияние температуры и прокаливания диураната аммония на остаточное содержание аммиака и воды
|
Остаточное содержание компонентов, % | |||
|
Температура | |||
|
прокаливания, |
|' " | ||
|
"С |
МНэ |
н»о | |
|
1 | |||
|
200 |
1,4-1,7 |
4,9—5,4 | |
|
300 |
0,3-0,5 |
0.9—1,4 | |
|
400 |
0,01—0.03 |
0,2—0,3 | |
|
600 |
Не обнаружен |
0,06 | |
|
800 |
Не обнаружен |
.Не обнаружен | |
