Производство этанола методом гидратации этилена
этанол + H+; – Н2О ↔ R+ + этанол ↔ ROR + H+ → ROH + олефин + H+.![]()
Внутримолекулярная дегидратация имеет более высокую энергию активации по сравнению с образованием простого эфира. По этой причине, а также из рассмотрения приведённой выше схемы следует, что дегидратацию с образованием ненасыщенной связи надо осуществлять при повышенной температуре и низком парциальном давлении или концентрации спирта. Дегидратацию с образованием простого эфира проводят при более низкой температуре, более высоких концентрации и парциальном давлении спирта (например, под некоторым давлением) и при неполной конверсии спирта в реакторе.
В результате рассматриваемых реакций нередко образуется ещё один побочный продукт – альдегид или кетон, получающийся за счёт дегидрирования спирта: С2Н5ОН → СН3СНО. Протонные кислоты не катализируют эту реакцию, но она становится возможной при использовании некоторых носителей или оксидных катализаторов. Из последних наиболее избирательны к дегидратации (по сравнению с дегидрированием) ThO2 и Al2O3, в то время как многие оксиды обладают смешанным, а другие – преимущественно дегидрирующим действием.
Термодинамика реакций
Рассмотрим равновесие основной реакции: гидратации – внутримолекулярной гидратации. Она протекает с выделением тепла, следовательно её равновесие смещается вправо при понижении температуры. Дегидратации, наоборот, способствует нагревание. Изменение энергии Гиббса при гидратации этилена, пропилена и изобутилена в зависимости от температуры представлено графически на (рис. 1.) Видно, что равновесие невыгодно для гидратации олефинов, так как при 150-300*С, когда катализаторы процесса достаточно активны, энергия Гиббса имеет большую положительную величину и равновесие смещается в сторону дегидратации. При этом для олефинов разного строения различия в термодинамике рассматриваемых реакций незначительны.
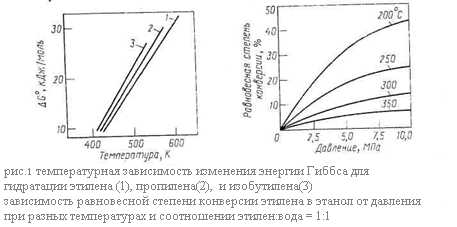
Как показывает стехиометрия реакций, на их равновесие можно влиять, изменяя давление. Внутримолекулярной дегидратации, идущей с увеличением числа молей веществ, способствует пониженное или обычное давление. Наоборот, гидратации олефинов благоприятствует высокое давление, увеличивающее равновесную степень конверсии олефина. Так последняя при 250 – 300 *С и атмосферном давлении составляет всего 0,1 – 0,2%, что совершенно неприемлемо для практических целей, но при 7 – 8 МПа и тех же температурах она возрастает до 12 – 20%. Зависимость равновесной степени конверсии этилена при его гидратации от давления и температуры изображена на рис.60, причём аналогичные кривые характерны и для других олефинов. Очевидно, что гидратации способствуют одновременное снижение температуры и повышение давления. Рассмотрим теперь равновесие в системе межмолекулярная дегидратация спиртов – гидролиз простых эфиров. Термодинамическим методом регулирования направления этих реакций является изменение давления: на образование простого эфира оно не влияет, но получению олефина его снижение благоприятствует.
Механизм и кинетика реакций
Все рассматриваемые реакции принадлежат к числу кислотно-каталитических процессов. Типичными катализаторами гидратации являются достаточно сильные протонные кислоты: фосфорная кислота на носителе, поливольфрамовая кислота, сульфокатиониты. Для дегидратации используют фосфорную кислоту на носителе, оксид алюминия, серную кислоту, фосфаты (например СаНРО4) и другие. Роль катализаторов при гидратации состоит в протонировании олефина через промежуточное образование π- и σ-комплексов, причём обратная реакция дегидратации идёт через те же стадии, но в противоположном направлении:
СН2=СН2 + Н+ = СН3=СН2+ + Н2О = СН3=СН2ОН + Н+
При межмолекулярной дегидратации карбокатион не отщепляет протон, а взаимодействует с другой молекулой спирта:
СН3=СН2+ + СН3=СН2ОН = [СН3=СН+2] 2 О+Н = [СН3=СН+2] 2 О + +Н
Электрофильный механизм дегидратации олефинов определяет уже отмеченные выше направления присоединения по правилу Марковникова, а также изменение реакционной способности олефинов, чем больше замещённость тем выше реакционная способность. В соответствии с этим этен самый нереакционноспособный. Для разных условий и катализаторов отношение реакционной способности олефинов меняется, составляя, например, для 80% серной кислоты 16 000: 1 000: 500: 1 и увеличиваясь для менее сильных кислот. Это очень существенно для выбора условий гидратации, особенно температуры: последняя может быть более низкой (и более благоприятной для равновесия) для изобутена по сравнению с пропиленом и особенно с этиленом.
Равновесие гидратации – дегидратации мало зависит от строения олефина и спирта, поэтому ряд реакционной способности олефинов к гидратации должен соответствовать аналогичному ряду спиртов по их способности к дегидратации:
Третичный > вторичный > первичный.
Эта способность особенно растёт у β-кето- и β-нитроспиртов, электроноакцепторные группы которых повышают кислотность атомов водорода, находящихся при соседнем с НО-группой углеродном атоме. Это нередко делает возможным некаталитическую, дегидратацию или даже катализ реакции основаниями:
–СОСН2–СНОН– + НО-; - Н2О = –СОСН-–СНОН– = –СОСН=СН– НО-
При гетерогенно-каталитической внутримолекулярной и межмолекулярной дегидратации в газовой фазе кинетика процесса описывается соответственно следующими уравнениями:
![]() ,
, ![]() .
.
Они учитывают практическую необратимость внутримолекулярной дегидратации и тормозящие влияние спирта и воды, лучше адсорбирующихся на активных центрах катализатора.
При гидратации олефинов вода всегда находится в избытке, поэтому тормозящим влиянием спирта можно пренебречь:
![]()
В ряде случаев роль воды более сложная. Так, фосфорная кислота, нанесённая на пористый носитель, образует на его поверхности жидкую плёнку, которая адсорбирует воду из газовой фазы. При каждых данных температуре и парциальном давлении водяных паров в газовой фазе устанавливается фазовое равновесие, и фосфорная кислота в плёнке имеет определённую концентрацию и соответствующую ей каталитическую активность. Последняя падает при снижении температуры и росте парциального давления воды, что ограничивает выбор этих параметров для каждого случая определёнными рамками.
При катализе реакций гидратации – дегидратации при помощи сульфокатионитов было найдено такое кинетическое уравнение:
![]()
Первый его член соответствует катализу сульфогруппами катионита, а второй – специфическому катализу ионами гидроксония Н3О+. если количество воды в смеси мало, в уравнении преобладает первое слагаемое, сильно зависящее от концентрации воды; повышение этой величины ведёт к преобладанию второго слагаемого.
