Процессы адгезии и когезии
1. При q= 0 cos Q = 1, Wa=Wk.
2. При q = 900 cos q = 0, Wa=Wk/2.
3. При q =1800 cos q = -1, Wa=0.
Последнее соотношение не реализуется.
Коэффициент растекания по Гаркинсу. Условие растекания и смачивания. Эффект Марангони. Правило Антонова
Рассмотрим условие растекания жидкости 2 по поверхности 3. Это условие можно получить из закона Юнга, приняв, что процесс проходит при q < 0. Тогда s31 ³ s23 + s21.
При этом условии равновесие становится невозможным и происходит растекание. Из уравнения следует, что уменьшение межфазного натяжения s23 и уменьшение поверхностного натяжения жидкости s21 способствует растеканию. Если разность s31 и s23 заменить выражением из уравнения Дюпре, что получим условие растекания в виде
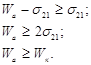
Таким образом, растекание происходит в том случае, если работа адгезии превышает работу когезии растекания жидкости. Разницу между левой и правой частями неравенства называют коэффициентом растекания f или коэффициентом растекания по Гаркинсу F
![]() ;
; ![]() .
.
При положительном значении коэффициента растекания жидкость растекается, при отрицательном - не растекается. Растекание жидкости с меньшим поверхностным натяжением по жидкости с бớльшим поверхностным натяжением называют эффектом Марангони. Под ним понимают движение в поверхностных слоях, вызванное градиентом поверхностного натяжения. Обычно неоднородность по поверхностному натяжению обусловлена неодинаковостью состава и температуры в разных точках межфазной поверхности. Течение происходит из области малых натяжений в сторону бớльших натяжений вследствие самопроизвольного уменьшения энергии Гиббса поверхности. Если предположить, что течение следует закону Ньютона, то напряжение сдвига давления записывается таким образом:
![]() ,
,
где х - направление по поверхности в направлении движения жидкости.
При растекании раствора поверхностно-активных веществ (ПАВ) градиент поверхностного натяжения можно разложить на два сомножителя:
![]() ,
,
где ![]() - характеризует поверхностную активность поверхностно-активных веществ (ПАВ);
- характеризует поверхностную активность поверхностно-активных веществ (ПАВ);
![]() - градиент его концентрации в направлении движения.
- градиент его концентрации в направлении движения.
Скорость течения раствора в межфазном слое пропорциональна напряжению сдвига:
![]() ,
,
где DС- разность концентрации в поверхностном слое, заменяющая градиент концентрации.
Из полученного соотношения следует, что скорость поверхностного течения раствора тем выше, чем больше поверхностная активность растворенного вещества и чем больше разность концентраций в направлении движения. Эффект играет существенную роль в процессах массопереноса.
Если одна жидкость находится в контакте с другой, то со временем происходит их взаимное насыщение. В результате разность между поверхностными натяжениями фаз уменьшается, что ведет к ухудшению растекания. Коэффициент растекания уменьшается почти до нуля. Это позволило сформулировать правило Антонова, в соответствии с которым формула для коэффициента растекания для систем с взаимно насыщенными жидкостями примет вид
![]() ,
,
где s31,s21 - поверхностное натяжение двух взаимно насыщенных жидкостей и s23- межфазное натяжение на границе между взаимно насыщенными жидкостями.
Если жидкости не растекаются друг по другу, то при взаимном насыщении коэффициент растекания отрицателен, это ведет к увеличению краевого угла и несоблюдению правила Антонова.
Адсорбция ионов на кристалле. Электрокинетические явления
Образование и строение ДЭС. Электрокинетический потенциал. Правила написания мицелл
Адсорбция электролитов сводится к адсорбции ионов, т.е. переходу ионов из одной фазы в другую. Это явление приводит к образованию двойного электрического слоя (ДЭС). Переход ионов обусловлен различием значения величины химического потенциала компонентов (ионов) в граничащих фазах. Ионы переходят из фазы с большим значением в фазу с меньшим значением. В результате на границе раздела фаз образуется скачок потенциала, который приостанавливает дальнейший переход ионов. В зависимости от значения ионы переходят из раствора на поверхность или наоборот. В обоих случаях поверхность приобретает избыточный заряд, который компенсируется ионами противоположного знака. Таким образом, на поверхности раздела фаз возникает двойной электрический слой (ДЭС).
Пути образования ДЭС:
1-й путь – адсорбционный;
2-й путь - поверхностная диссоциация.
Рассмотрим 1-й путь. Пусть происходит реакция
AgNO3 + KCl ® AgCl + KNO3
Примем, что в избытке KCl. Образующиеся кристаллы AgCl находятся в ионном растворе, содержащем ионы К+, Сl-, NO3-, при условии ж(Cl-) >т(Сl-). Ионы Cl переходят из раствора в твердую фазу, т.е. адсорбируются на твердой поверхности кристалла, на границе раздела фаз не возникает необходимость для равновесия скачка потенциала. Поверхность кристалла при этом приобретает отрицательный заряд. Поскольку согласно правилу Фаянса - Панета – Пескова на кристалле адсорбируются ионы общей природы с ионами кристалла или изоморфные им, т.е. способные достраивать кристаллическую решетку.

В нашем случае адсорбция ионов Cl- происходит за счет химических сил, приводящих к прочному присоединению их к кристаллу. Оставшиеся в растворе ионы К+ электростатически притягиваются к поверхности и восстанавливают нарушения электронейтральности системы. Однако прочно к поверхности они не присоединяются, а так как их концентрация около поверхности больше, чем в растворе, то они диффундируют в сторону меньшей концентрации, т.е. от поверхности в раствор. На поверхности кристалла возникает двойной электрический слой (ДЭС), имеющий следующее строение:
ДЭС состоит из внутренней обкладки или адсорбционного слоя (ионы Cl-) и наружной обкладки или слоя противоионов (ионы К+). Часть противоионов связано с поверхностью относительно прочно и входит в плотный слой. Остальные противоионы, совершающие тепловое движение около поверхности, составляют диффузионную часть двойного электрического слоя (ДЭС). Распределение противоионов плотной и диффузной частей определяется соотношением между электростатическими притяжением ионов к поверхности и их диффузии в растворе. Последнее определяется тепловым движением ионов и зависит от разности концентрации в двойном электрическом слое (ДЭС) и объеме раствора. Если для реакции взять избыток AgNO3, то внутренняя обкладка двойного электрического слоя (ДЭС) будет состоять из ионов Ag, а противоположными будет NO3. Примером двойного электрического слоя (ДЭС), образованного путем поверхностной диссоциации, является двойной электрический слой (ДЭС), возникающий на поверхности стекла в H2O за счет катионов К, Na и т.п. Таким образом, поверхность стекла в H2O заряжается отрицательно. Растворение материала поверхности и возникновение на ней двойного электрического слоя (ДЭС) можно вызвать добавлением веществ, реагирующих с поверхностью. Например, амфотерный Al(OH)3 в присутствии кислоты заряжается положительно, а в щелочи отрицательно.
