Процессы, механизмы и кинетические модели в синтетической химии
Окислительная димеризация алкинов (реакция Глязера-Залькинда) занимает важное место в синтетической химии.
![]()
В этой реакции, в отличие от Вакер-процесса, оба компонента каталитической системы Cu(I) и Cu(II) принимают участие в образовании продукта, а О2 (или другой окислитель, Q, Fe(CN)63– и т.д.) регенерирует необходимую для реакции форму Cu(II). Дегидроконденсацию алкинов можно провести в электрохимической системе (в анодной камере электролизера), например, по реакции
![]()
При использовании в качестве окислителя Cu(OAc)2 в Ру реакция является автокаталитической. В системе CuCl-CuCl2-LiCl-H2O при большом избытке LiCl (т.е. при постоянной концентрации Cl–) скорость димеризации метилацетилена описывается уравнением
![]()
свидетельствующем о наличии лимитирующей стадии и аниона RCºC– в переходном состоянии лимитирующей стадии
[(RCºC–)·2Cu(I)·Cu(II)]≠
Таким образом, продукт превращения интермедиата RCºCCu·CuCl в реакции с CuCl2 (Х1) и является интермедиатом, участвующим в образовании диалкина. Предполагается следующая схема реакции:
![]()
![]()
![]()
![]()
Образование радикала RCºC· в стадии (с его последующей димеризацией) не проходит по термохимическим соображениям. В Мерокс-процесе стадия с участием RS· возможна. Похожая на реакцию димеризации HCN также осуществляется в растворах Cu(I)-Cu(II)
![]()
Гидролиз дициана дает оксамид NH2COCONH2 – очень ценное удобрение.
Синтез оксида этилена. Этиленоксид (ЭО) получают по реакции
![]()
на серебряных катализаторах 15% Ag/a-Al2O3 при 240 – 270оС и давлении 3МПа. При конверсии этилена < 10% селективность 80 – 85%. Побочная реакция – глубокое окисление этилена до СО2. Селективность процесса повышают добавками Cl (NaCl) в катализатор или добавками дихлорэтана в сырье в количестве 2 – 10 ppm. СО2 образуется из С2Н4 и при окислении ЭО, поэтому химизм процесса определяется совокупностью параллельно-последовательных реакций
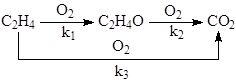
Обсуждаются различные гипотезы о механизме процесса, предполагающие образование СО2 на тех же центрах ZO2, на которых образуется ЭО, или участие разных центров в образовании ЭО (ZO2) и СО2 (ZO). Скорость расходования О2 в области PC2H4 > 0.9 атм на промотированном хлором катализаторе описывается уравнением первого порядка по РО2 (лимитирует адсорбция О2). При РО2 > 0.5 атм и PC2H4 ≤ 0.02
![]()
Для очень простой схемы
![]()
![]()
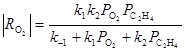
Из уравнения получаются оба частных случая. Процесс тормозится ЭО и СО2, поэтому, например, при PC2H4 > 0.9 атм в условиях первого порядка по РО2
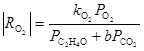
Если поверхностные соединения серебра и кислорода представить в виде химических соединений, то центрам Z, ZO2 и ZO можно сопоставить Ag2O, Ag2O3 и Ag2O2, соответственно. Имеются и другие представления об адсорбированных на поверхности серебра формах кислорода, в том числе и об участии в реакции атомов кислорода (или О–), находящихся в приповерхностном слое.
Синтез винилацетата (реакция Моисеева). Реакция окислительной этерификации или окислительного ацетоксилирования олефинов
![]()
была открыта в МИТХТ им. Ломоносова в 1960 г. Реакция осуществляется в растворах солей PdCl2-CuCl2 и Cu(OAc)2 в уксусной кислоте в присутствии NaOAc. Температура процесса 110 – 130оС и давление 3.0 – 4.0 МПа. Селективность по этилену – 83%. Кинетическое уравнение получено Моисеевым и Беловым в системе, не содержащей CuCl2
![]()
в предположении, что в условиях квадратичного торможения ацетатом натрия весь Pd(II) находится в форме комплекса Na2Pd(OAc)4. В работе П.Генри приведена другая форма уравнения в предположении, что активной формой Pd(II) является димер Na2Pd2(OAc)6, концентрация которого проходит через максимум по [NaOAc]
![]()
Процесс синтеза винилацетата по реакции протекает в рамках механизма, аналогичного "Вакер"-процессу. Предполагается превращение p-комплекса Pd(II) в s-палладийорганическое соединение под действием OAc– из раствора, а распад полученного интермедиата включает стадию b-элиминирования ~PdH
![]() ,
,
где [Pd] – мономерный или димерный комплекс Pd(II). Окислением H-[Pd] и заканчивается каталитический цикл.
Фирмы Hoechst и др. разработали для реакции (15) гетерогенный катализатор, содержащий соли Pd(II), Au(III) и KOAc на Al2O3. Процесс протекает при 175 – 200 оС и давлении 0.5 – 1.0 МПа с высокой селективностью: 94% по этилену и 98% по уксусной кислоте. Состояние Pd(II) в условиях процесса и роль соединений золота пока не ясны.
Халкон-процесс. Эпоксидирование олефинов гидропероксидами осуществляется в промышленном варианте в растворах комплексов Mo(VI). В качестве ROOH используют 2-этилфенилгидропероксид (гидропероксид этилбензола, ГПЭБ), гидропероксид кумила (ГПК) и третбутилгидропероксид (ТБГП). В случае ГПЭБ сопряженно с пропиленоксидом получают стирол:
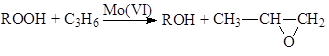
![]()
Скорость реакции описывается уравнением
![]()
где FMo = 1 + KГПЭБ[ГПЭБ] + KМФК[МФК] + KОП[ОП] + KH2O[H2O] есть закомплексованность катализатора, МФК – метилфенилкарбинол, ОП – пропиленоксид. Ki – константы равновесия образования соответствующих комплексов Mo. Как видно из уравнения, процесс протекает с лимитирующей стадией, переходное состояние которой включает ГПЭБ, Mo(VI) и пропилен. Показано, что активным катализатором является пропиленгликолятный комплекс Mo(VI), реакция которого с ГПЭБ и C3H6 приводит к ОП.
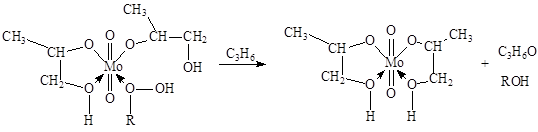
Окисление спиртов. Окисление (или окислительное дегидрирование) спиртов на металлических и окисных катализаторах до альдегидов и кетонов является важным промышленным процессом.
