Процессы, механизмы и кинетические модели в синтетической химии
Рассмотрим подробнее процесс окисления метанола до формальдегида
![]()
В промышленности реализованы два варианты процесса окисления:
на оксидах MoO3-Fe2O3 (и др. оксидных катализаторах) процесс протекает в кинетической области при 300 – 350оС и 15-кратном избытке воздуха по отношению к метанолу. При этом достигаются 100% превращение спирта, высокая селективность и синтез безметанольного формальдегида, необходимого для процессов его полимеризации.
На серебряных катализаторах (мелкокристаллическое серебро, Ag/пемза, Ag/a-Al2O3 и др.) процесс протекает в адиабатическом режиме в тонком слое катализатора (8 – 10 см) во внешнедиффузионной области. Количество подаваемого кислорода ~0.9 от стехиометрии.
И основная реакция, и побочная реакция
![]()
– экзотермические процессы. Эндотермический процесс дегидрирования, который имеет место в условиях процесса
![]()
не компенсируют большого количества выделяющегося тепла. Поэтому при низких температурах (220 – 250оС) процесс протекает в кинетическом режиме, однако при больших нагрузках по спирту и небольшом количестве воздуха процесс не удерживается в изотермическом режиме, и начинается быстрый подъем температуры, обусловленный плохим отводом тепла и повышением температуры зерна катализатора Тз. Повышение Тз вызывает экспоненциальный рост скорости, рост количества выделяющегося тепла qподв (ккал/(л·час)) и еще больший рост Тз, который останавливается в новом стационарном состоянии при высоком градиенте Тз – Tf (Tf – температура газа), обеспечивающем равенство отводимого и подводимого тепла qподв @ qотв. Таким образом:
в области низких температур Тз @ Tf, qподв @ qотв, процесс протекает в кинетической области (область i);
при повышении Тз возникает неустойчивый режим (область n);
при Тз > Tf режим адиабатический (qподв @ qотв), внешнедиффузионная область, режим "зажигания", работает тонкий слой катализатора (область k).
Температуру адиабатического разогрева можно оценить по уравнениям
![]() ;
; ![]() ,
,
где a – объемный коэффициент теплоотдачи (кал/(л·час·гр)), Q – количество выделяемого тепла (кал/моль), Cfb – скорость реакции в диффузионном режиме, b – коэффициент скорости диффузии, Cf – концентрация спирта в потоке.
При равенстве qподв = qотв,
![]() ,
,
где n – теплоемкость, кал/(л·гр).
Режим зажигания устанавливается при
![]() , где
, где ![]() ,
,
Е – наблюдаемая энергия активации процесса.
В режиме диффузионного "зажигания" Tf = 650 – 700оС, Тз = 900 – 1000оС, но при малых временах контакта селективность процесса достигает 95% при 90% конверсии метанола. Полученный в результате абсорбции водой раствор 40% формальдегида (формалин) можно использовать как товарный продукт.
Окислительное хлорирование этилена до дихлорэтана. Процесс синтеза дихлорэтана (ДХЭ) по реакции
![]()
протекает в области 325 – 525оС (лучше 350 – 400оС) на меднохлоридных катализаторах CuCl-KCl/SiO2 или CuCl2/g-Al2O3 практически при 100% конверсии HCl с выходом ДХЭ по этилену ~ 96%. Дихлорэтан образуется на поверхности катализатора без участия свободного Cl2. Механизм реакции изучен весьма детально. Схема механизма приведена ниже для второго катализатора.
![]()
![]()
![]()
![]()
![]()
![]()
Если вектор стехиометрических чисел стадий маршрута равен |2 2 2 2 1 1|, получим итоговое уравнение. Скорость образования ДХЭ описывается уравнением с учетом 2-х медленных стадий (3) и (5):
![]() ,
,
где 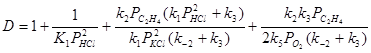 .
.
При PHCl ³ 2 кПа реализуется нулевой порядок по PHCl, и при определенных соотношениях констант уравнение преобразуется к виду
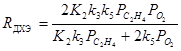
Реакции окисления в промышленной неорганической химии
Каталитические процессы активно применяются для окисления неорганических соединений с целью получения полезных продуктов и для очистки газовых выбросов и водных стоков.
![]()
(процессы дожигания СО, очистка воздуха помещений)
![]()
(получение серы, очистка природного и попутных газов от H2S)
![]()
(процесс Клауса, очистка газовых выбросов и синтез серы)
![]()
(производство H2SO4)
![]()
(производство HNO3)
![]()
(Дикон-процесс, синтез Cl2)
![]()
(производство HNO3)
![]()
(производство N2O)
![]()
(очистка стоков)
Рассмотрим в качестве примера реакцию (Н4):
![]()
На двух различных катализаторах Fe2O3/SiO2 (1) и V2O5–K2SO4/Al2O3 (2) скорость реакции описывается кинетическим уравнением, полученным для случая неоднородной поверхности.
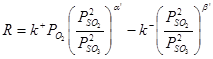
где a' = 0.75 и b' = 0.25 для железооксидного катализатора (1) и a' = 0.4 и b' = 0.6 для ванадийоксидного катализатора (2).
Схема механизма, соответствующая уравнению
![]()
![]()
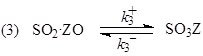
лимитирующая стадия
![]()
Реакции окисления SO2 на Pt (H4), NO и NH3 на Pt-Rh (H5 и H7) протекают в адиабатическом режиме диффузионного "зажигания".
Вопросы для самоконтроля
Привести варианты классификации реакций окисления.
